Microcystin-LR
(5R ,8S ,11R ,12S ,15S ,18S ,19S ,22R )-15-[3-(diaminomethylideneamino)propyl]-18-[(1E ,3E ,5S ,6S )-6-Methoxy-3,5-dimethyl-7-phenylhepta-1,3-dienyl]-1,5,12,19-tetramethyl-2-methylidene-8-(2-methylpropyl)-3,6,9,13,16,20,25-heptaoxo-1,4,7,10,14,17,21-heptazacyclopentacosane-11,22-dicarboxylic acid
別称
5-L -Arginine-microcystin LA
識別情報
略称
MC-LR, MCYST-LR
CAS登録番号 101043-37-2
PubChem
24896778
ChemSpider
4941647
UNII
EQ8332842Y
EC番号
621-323-9
KEGG
C05371
ChEBI
ChEMBL
CHEMBL444092
4735
CC1C(NC(=O)C(NC(=O)C(C(NC(=O)C(NC(=O)C(NC(=O)C(=C)N(C(=O)CCC(NC1=O)C(=O)O)C)C)CC(C)C)C(=O)O)C)CCCN=C(N)N)C=CC(=CC(C)C(CC2=CC=CC=C2)OC)C
InChI=1S/C49H74N10O12/c1-26(2)23-37-46(66)58-40(48(69)70)30(6)42(62)55-35(17-14-22-52-49(50)51)45(65)54-34(19-18-27(3)24-28(4)38(71-10)25-33-15-12-11-13-16-33)29(5)41(61)56-36(47(67)68)20-21-39(60)59(9)32(8)44(64)53-31(7)43(63)57-37/h11-13,15-16,18-19,24,26,28-31,34-38,40H,8,14,17,20-23,25H2,1-7,9-10H3,(H,53,64)(H,54,65)(H,55,62)(H,56,61)(H,57,63)(H,58,66)(H,67,68)(H,69,70)(H4,50,51,52)/b19-18+,27-24+/t28-,29-,30-,31+,34-,35-,36+,37+,38-,40+/m0/s1
Key: ZYZCGGRZINLQBL-JCGNTXOTSA-N
InChI=1S/C49H74N10O12/c1-26(2)23-37-46(66)58-40(48(69)70)30(6)42(62)55-35(17-14-22-52-49(50)51)45(65)54-34(19-18-27(3)24-28(4)38(71-10)25-33-15-12-11-13-16-33)29(5)41(61)56-36(47(67)68)20-21-39(60)59(9)32(8)44(64)53-31(7)43(63)57-37/h11-13,15-16,18-19,24,26,28-31,34-38,40H,8,14,17,20-23,25H2,1-7,9-10H3,(H,53,64)(H,54,65)(H,55,62)(H,56,61)(H,57,63)(H,58,66)(H,67,68)(H,69,70)(H4,50,51,52)/b19-18+,27-24+/t28-,29-,30-,31+,34-,35-,36+,37-,38-,40+/m0/s1
特性
化学式
C49 H74 N10 O12
モル質量
995.17 g mol−1
外観
White solid
密度
1.299 g/cm3
ethanolへの溶解度
1 mg/mL
log POW
-1.44
薬理学
投与経路
Ingestion
危険性
GHSピクトグラム
GHSシグナルワード
危険(DANGER)
Hフレーズ
H300 , H310 , H315 , H317 , H319 , H335
主な危険性
extremely toxic
半数致死量 LD50
5 mg/kg
特記なき場合、データは常温 (25 °C )・常圧 (100 kPa) におけるものである。
ミクロシスチンLR またはマイクロシスチンLR (英 : microcystin-LR 、MC-LR)は、シアノバクテリア によって産生される毒素の1つである。ミクロシスチン 類の中で最も毒性が高い。
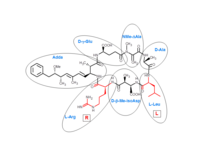
ミクロシスチンは環状ヘプタペプチドである。ミクロシスチンを構成する7つのアミノ酸 には、Adda (英語版 ) D -β-メチルイソアスパラギン酸(英語版 ) D -β-Me-isoAsp、Masp)といった固有のものが含まれている。さらに、ミクロシスチンには2つの可変残基が存在し、この残基の差異がミクロシスチン間の差異となっている。これら2つの可変残基は常に標準アミノ酸 であり、ミクロシスチンLRの場合にはロイシン (L)とアルギニン (R)である。
ミクロシスチンLRの化学構造。7つのアミノ酸から構成される。 今日までに250種類のミクロシスチンが同定されているが[ 1] D -Glu のメチルアステル化など他のアミノ酸の一部の修飾が異なっている。ミクロシスチン類はそれぞれ毒性プロファイルが異なり、中でもミクロシスチンLRは最も毒性が高いことが知られている[ 2] [ 3]
ミクロシスチンは非リボソームペプチド である。ミクロシスチンLRはミクロキスティス・エルギノーサ (英語版 ) Microcystis aeruginosa において、55 kbのミクロシスチン遺伝子クラスター(mcy )にコードされるタンパク質群によって合成される。この遺伝子クラスターにはポリケチドシンターゼ (英語版 ) mcyA –E 、G )と4つの小さな遺伝子(mcyF 、H –J )が含まれている。大きなタンパク質はさまざまなタンパク質ドメイン(モジュール)から構成されており、それぞれ固有の酵素機能を有している[ 4] [ 4] [ 5]
M. aeruginosa におけるミクロシスチンLRの生合成は、フェニル酢酸 とmcyGとの共役によって開始される。そしてさまざまな酵素、さまざまなモジュールによって触媒される一連の反応によって、ミクロシスチンLRは形成される。全生合成経路は図に示されている。
M. aeruginosa によるミクロシスチンLR生合成経路合成の第一部では、フェニル酢酸のアセチル基 とフェニル基 の間へいくつかの炭素・酸素原子が挿入される。この段階は、β-ケトアシルシンターゼ、アシルトランスフェラーゼ 、C-メチルトランスフェラーゼ 、ケトアシルレダクターゼ活性を有する酵素ドメインによって触媒される。この段階の完結、すなわちグルタミン酸の縮合によって、Addaが形成される[ 4] [ 4]
さまざまなミクロシスチンは、ミクロシスチンLRとほぼ同じ酵素群によって合成される[ 6]
ミクロシスチンLRは、肝細胞 の細胞質においてプロテインホスファターゼ PP1 とPP2A の活性を阻害する。その結果、肝細胞内ではタンパク質のリン酸化 が増大する。ミクロシスチンLRとホスファターゼの相互作用は、ミクロシスチンLRのメチレン基 とホスファターゼ触媒サブユニットのシステイン 残基との間での共有結合 の形成を伴う。ミクロシスチンLRはホスファターゼの触媒中心に直接結合し、基質の活性部位へのアクセスを遮断して酵素活性を阻害する。この結果、肝細胞内でプロテインホスファターゼが阻害されてリン酸化タンパク質が蓄積し、肝毒性につながる。
プロテインホスファターゼの触媒サブユニットの活性部位は、hydrophobic groove、acidic groove、C-terminal grooveと呼ばれる3つの溝からなるY字型構造である。ミクロシスチンLRのAdda部分はhydrophobic grooveに収容され、D -Glu部分のカルボキシル基は金属に結合した水分子と、Masp部分のカルボキシル基 は酵素の保存されたアルギニン、チロシン 残基とそれぞれ水素結合 を形成する。そしてMdha部分のメチレン基はシステイン残基の硫黄原子に共有結合し、ミクロシスチンLRのロイシン部分はもう1つの保存されたチロシン残基に対してパッキングする[ 2]
ミクロシスチンLRは、ヒトと動物の双方に毒性を有する。シアノトキシン の毒性は、神経毒性 、肝毒性 、化学熱傷 を伴う細胞毒性 など多岐にわたる。ミクロシスチンは一般的に肝毒性と関連しており、プロテインホスファターゼの阻害によって毒性効果を発揮する[ 7]
シアノバクテリアを原因とする中毒として最初に公表された報告は、1878年にオーストラリアの池で発生した中毒である[ 8] [ 9] ブラジル のカルアル でのアウトブレイクであり、116人に視覚障害、吐き気、嘔吐、筋力低下といった複数の症状がみられた。100人が急性肝不全 を発症し、52人が"Caruaru Syndrome"と呼ばれる一連の症状で犠牲となった[ 10] 透析 治療が原因であった[ 11]
ミクロシスチンは肝毒素である。急性曝露後には、重度の肝損傷が肝細胞構造の破壊という形でみられる。さらに、肝出血による肝重量の増大、ショック 、心不全 、死が引き起こされる[ 12]
致死量のミクロシスチンLRを注入されたマウスは、注入後数時間で死に至る[ 13] [ 12] [ 7]
投与経路[ 14]
毒性
生物種
値
経口
LD50
マウス
5 mg/kg
吸入, 10h
LC50
マウス
18 mg/kg
腹腔内
LD50
ラット
0.05 mg/kg
腹腔内
LD50
マウス
0.0325 mg/kg
静脈内
LD50
マウス
0.06 mg/kg
マウスにおいて、純粋なミクロシスチンLRを体重1 kgあたり0、40、200、1000 μgを毎日経口投与した実験が行われている。最も高い投与量では、ほぼすべてのマウスで肝機能の変化、慢性炎症、その他いくつかの症状がみられた。メスのマウスでは、最も高い投与量でトランスアミナーゼ 濃度の変化も観察された[ 12]
IARC は、ミクロシスチンLRをグループ2B (possibly carcinogenic)に分類している。ミクロシスチンは腫瘍の成長を刺激する可能性があり、ミクロシスチンLRを摂取しているマウスは、発がん性物質DMBA で処理した際の皮膚腫瘍の数と重量が増加することが示されている[ 9] M. aeruginosa のブルームの抽出物を1年間経口投与しても腫瘍数の増加は引き起こされないという報告がある一方で、28週間にわたって週4回20 μg/kg体重を投与されたマウスでは肝臓に新生物がみられるという報告もある[ 7]
WHOはミクロシスチンLRは変異原 としては作用しないとしている。しかしながらマウスでは、ミクロシスチンの単回経口投与後にリンパ球 においてDNA切断が誘発されることが観察されている。この作用は、時間と投与量に依存的である。曝露4時間後の時点では、DNA損傷応答に関与する遺伝子の発現に変化はみられないが、24時間後にはDNA損傷応答遺伝子がアップレギュレーションされる。このことは、ミクロシスチンLRが間接的に遺伝毒性物質として作用していることを示している[ 15] 肝がん の発生率が最も高い地域は表流水にシアノバクテリアが大量に生息する地域である[ 7]
ミクロシスチンLRは、シアノバクテリアが大量発生した川の水の飲用により、ペットや家畜、野生動物にも影響を及ぼす。ペットや家畜にみられる中毒症状には下痢、嘔吐、衰弱、横臥などがあり、ほとんどの場合致命的である[ 16] [ 17]
シアノバクテリアは、湖沼、貯水池や流れの緩やかな水域を好んで生息する。大部分のシアノバクテリアが毒素を産生するが、ミクロシスチンはその1グループにすぎない。シアノバクテリアが死ぬと、その細胞壁 は分解され毒素が水中に放出される。ミクロシスチンは水中での安定性が極めて高く、加水分解や酸化といった化学分解に耐えることができる。ミクロシスチンの半減期はpH 1、40 °Cという条件下でも3週間であり、一般的な環境条件下では10週間にもなる[ 12] [ 18] 富栄養化 した水域ではミクロシスチン濃度は10 μg/Lに達することがある[ 19] [ 20] [ 21] [ 22] [ 23]
ミクロシスチンLRは血漿 から迅速に排出される。分布と排泄段階に相当するα段階とβ段階は、それぞれ0.8分、6.9分である[ 18] [ 24] [ 24] [ 24]
ヒトでのミクロシスチン代謝に関するデータは極めて乏しい。毒素の代謝や蓄積に関するデータはマウスやラットを用いたものがより豊富に存在する。これらの動物ではミクロシスチンLRは肝臓で迅速に濃縮される[ 25] シトクロムP450 (CYP450)やシトクロムb5 (英語版 )
薬物代謝 の第2相は、さまざまな内因性物質との抱合である。ミクロシスチンLRはグルタチオン 抱合体やシステイン 抱合体として排出されることが知られている。グルタチオンやシステインはMdha部分と抱合する。また、Adda部分での硫酸抱合によって生成されると推定される代謝物も検出される[ 26]
ロトルア湖 やその他の地域からは、microcystinaseと呼ばれるメタロプロテアーゼ が単離されている。この酵素はミクロシスチンを毒性が1/160の物質へ変換する[ 27]
^ Bouaïcha, Noureddine; Miles, Christopher O.; Beach, Daniel G.; Labidi, Zineb; Djabri, Amina; Benayache, Naila Yasmine; Nguyen-Quang, Tri (2019-12-07). “Structural Diversity, Characterization and Toxicology of Microcystins” . Toxins 11 (12): 714. doi :10.3390/toxins11120714 . ISSN 2072-6651 . PMC 6950048 . PMID 31817927 . https://pubmed.ncbi.nlm.nih.gov/31817927 . ^ a b Pereira, Susana R.; Vasconcelos, Vítor M.; Antunes, Agostinho (2013-01). “Computational study of the covalent bonding of microcystins to cysteine residues--a reaction involved in the inhibition of the PPP family of protein phosphatases” . The FEBS journal 280 (2): 674–680. doi :10.1111/j.1742-4658.2011.08454.x . ISSN 1742-4658 . PMID 22177231 . https://pubmed.ncbi.nlm.nih.gov/22177231 .
^ Campos, Alexandre; Vasconcelos, Vitor (2010-01-21). “Molecular mechanisms of microcystin toxicity in animal cells” . International Journal of Molecular Sciences 11 (1): 268–287. doi :10.3390/ijms11010268 . ISSN 1422-0067 . PMC 2821003 . PMID 20162015 . https://pubmed.ncbi.nlm.nih.gov/20162015 . ^ a b c d Tillett, D.; Dittmann, E.; Erhard, M.; von Döhren, H.; Börner, T.; Neilan, B. A. (2000-10). “Structural organization of microcystin biosynthesis in Microcystis aeruginosa PCC7806: an integrated peptide-polyketide synthetase system” . Chemistry & Biology 7 (10): 753–764. doi :10.1016/s1074-5521(00)00021-1 . ISSN 1074-5521 . PMID 11033079 . https://pubmed.ncbi.nlm.nih.gov/11033079 .
^ Christiansen, Guntram; Fastner, Jutta; Erhard, Marcel; Börner, Thomas; Dittmann, Elke (2003-01). “Microcystin biosynthesis in planktothrix: genes, evolution, and manipulation” . Journal of Bacteriology 185 (2): 564–572. doi :10.1128/JB.185.2.564-572.2003 . ISSN 0021-9193 . PMC PMC145317 . PMID 12511503 . https://pubmed.ncbi.nlm.nih.gov/12511503 . ^ Nishizawa, T.; Ueda, A.; Asayama, M.; Fujii, K.; Harada, K.; Ochi, K.; Shirai, M. (2000-05). “Polyketide synthase gene coupled to the peptide synthetase module involved in the biosynthesis of the cyclic heptapeptide microcystin” . Journal of Biochemistry 127 (5): 779–789. doi :10.1093/oxfordjournals.jbchem.a022670 . ISSN 0021-924X . PMID 10788786 . https://pubmed.ncbi.nlm.nih.gov/10788786 . ^ a b c d “National Toxicology Program Microcystin Toxicity report ”. National Institute of Environmental Health Sciences. 1 March 2012 閲覧。
^ Francis, George (1878-05). “Poisonous Australian Lake” (英語). Nature 18 (444): 11–12. doi :10.1038/018011d0 . ISSN 0028-0836 . https://www.nature.com/articles/018011d0 . ^ a b Bulter, N., Carlisle, J.C. (January 2009). “MICROCYSTINS: A BRIEF OVERVIEW OF THEIR TOXICITY AND EFFECTS, WITH SPECIAL REFERENCE TO FISH, WILDLIFE, AND LIVESTOCK ”. oehha.ca.gov . The California Environmental Protection Agency's Office of Environmental Health Hazard Assessment. 2024年6月9日 閲覧。
^ Azevedo, Sandra M. F. O.; Carmichael, Wayne W.; Jochimsen, Elise M.; Rinehart, Kenneth L.; Lau, Sharon; Shaw, Glen R.; Eaglesham, Geoff K. (2002-12-27). “Human intoxication by microcystins during renal dialysis treatment in Caruaru-Brazil” . Toxicology 181-182 : 441–446. doi :10.1016/s0300-483x(02)00491-2 . ISSN 0300-483X . PMID 12505349 . https://pubmed.ncbi.nlm.nih.gov/12505349 . ^ Jochimsen, E. M.; Carmichael, W. W.; An, J. S.; Cardo, D. M.; Cookson, S. T.; Holmes, C. E.; Antunes, M. B.; de Melo Filho, D. A. et al. (1998-03-26). “Liver failure and death after exposure to microcystins at a hemodialysis center in Brazil” . The New England Journal of Medicine 338 (13): 873–878. doi :10.1056/NEJM199803263381304 . ISSN 0028-4793 . PMID 9516222 . https://pubmed.ncbi.nlm.nih.gov/9516222 . ^ a b c d “Cyanobacterial toxins: Microcystin-LR in drinking-water. Background document for preparation of WHO Guidelines for drinking-water quality. ”. WHO (2003年). 2024年6月9日 閲覧。
^ Slatkin, D. N.; Stoner, R. D.; Adams, W. H.; Kycia, J. H.; Siegelman, H. W. (1983-06-24). “Atypical pulmonary thrombosis caused by a toxic cyanobacterial peptide” . Science (New York, N.Y.) 220 (4604): 1383–1385. doi :10.1126/science.6407109 . ISSN 0036-8075 . PMID 6407109 . https://pubmed.ncbi.nlm.nih.gov/6407109 . ^ “Microcystin LR from Microcystis aeruginosa ”. Sigma-Aldrich. 1 March 2012 閲覧。 ^ Zegura, B.; Gajski, G.; Straser, A.; Garaj-Vrhovac, V.; Filipič, M. (2011-12-24). “Microcystin-LR induced DNA damage in human peripheral blood lymphocytes” . Mutation Research 726 (2): 116–122. doi :10.1016/j.mrgentox.2011.10.002 . ISSN 0027-5107 . PMID 22001196 . https://pubmed.ncbi.nlm.nih.gov/22001196 . ^ DeVries, S. E.; Galey, F. D.; Namikoshi, M.; Woo, J. C. (1993-07). “Clinical and pathologic findings of blue-green algae (Microcystis aeruginosa) intoxication in a dog” . Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc 5 (3): 403–408. doi :10.1177/104063879300500317 . ISSN 1040-6387 . PMID 8373855 . https://pubmed.ncbi.nlm.nih.gov/8373855 . ^ Briand, Jean-François; Jacquet, Stéphan; Bernard, Cécile; Humbert, Jean-François (2003). “Health hazards for terrestrial vertebrates from toxic cyanobacteria in surface water ecosystems” . Veterinary Research 34 (4): 361–377. doi :10.1051/vetres:2003019 . ISSN 0928-4249 . PMID 12911854 . https://pubmed.ncbi.nlm.nih.gov/12911854 . ^ a b Bartram, Jamie; Chorus, Ingrid (1999). Toxic cyanobacteria in water: a guide to their public health consequences, monitoring and management . London: E & FN Spon. ISBN 978-0-419-23930-7
^ Oberholster, Paul Johan; Botha, Anna-Maria (2010-12) (英語). Use of remote sensing and molecular markers to detect toxic cyanobacterial hyperscum crust : A case study on Lake Hartbeespoort, South Africa ISSN 1684-5315 . https://repository.up.ac.za/handle/2263/15851 . ^ “Water pollution and South Africa's poor ” (英語). Institute of Race Relations . 2024年6月19日 閲覧。 ^ Turton, Anthony (2016-12-01). “South Africa and the drought that exposed a young democracy” (英語). Water Policy 18 (S2): 210–227. doi :10.2166/wp.2016.020 . ISSN 1366-7017 . https://iwaponline.com/wp/article/18/S2/210/20549/South-Africa-and-the-drought-that-exposed-a-young . ^ Matthews, M. W.; Bernard, Stewart (2015-05) (英語). Eutrophication and cyanobacteria in South Africa’s standing water bodies: A view from space ISSN 0038-2353 . https://researchspace.csir.co.za/dspace/handle/10204/8543 . ^ Metcalf, James S.; Codd, Geoffrey A. (2000). “Microwave oven and boiling waterbath extraction of hepatotoxins from cyanobacterial cells” . FEMS Microbiology Letters 184 (2): 241–246. doi :10.1111/j.1574-6968.2000.tb09021.x . PMID 10713428 . https://www.researchgate.net/publication/227807451 . ^ a b c Robinson, N. A.; Pace, J. G.; Matson, C. F.; Miura, G. A.; Lawrence, W. B. (1991-01). “Tissue distribution, excretion and hepatic biotransformation of microcystin-LR in mice” . The Journal of Pharmacology and Experimental Therapeutics 256 (1): 176–182. ISSN 0022-3565 . PMID 1988656 . https://pubmed.ncbi.nlm.nih.gov/1988656 .
^ Brooks, W. P.; Codd, G. A. (1987-03). “Distribution of Microcystis aeruginosa peptide toxin and interactions with hepatic microsomes in mice” . Pharmacology & Toxicology 60 (3): 187–191. doi :10.1111/j.1600-0773.1987.tb01731.x . ISSN 0901-9928 . PMID 3108872 . https://pubmed.ncbi.nlm.nih.gov/3108872 . ^ Kondo, F.; Matsumoto, H.; Yamada, S.; Ishikawa, N.; Ito, E.; Nagata, S.; Ueno, Y.; Suzuki, M. et al. (1996-12). “Detection and identification of metabolites of microcystins formed in vivo in mouse and rat livers” . Chemical Research in Toxicology 9 (8): 1355–1359. doi :10.1021/tx960085a . ISSN 0893-228X . PMID 8951240 . https://pubmed.ncbi.nlm.nih.gov/8951240 . ^ Somdee, Theerasak; Thunders, Michelle; Ruck, John; Lys, Isabelle; Allison, Margaret; Page, Rachel (2013). “Degradation of [Dha7]MC-LR by a Microcystin Degrading Bacterium Isolated from Lake Rotoiti, New Zealand” . ISRN Microbiology 2013 : 1–8. doi :10.1155/2013/596429 . PMC 3712209 . PMID 23936728 . https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3712209/ .