|
Fluorene
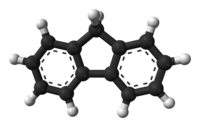
Il fluorene, nome sistematico 9H-fluorene, è un idrocarburo triciclico aromatico avente formula molecolare C13H10, esprimibile più espressivamente come (C6H4)2CH2.[2] Solo i due anelli esaatomici laterali sono aromatici; tuttavia, similmente al ciclopentadiene (e all'indene), il metilene nell'anello pentaatomico centrale è facilmente deprotonabile, dando luogo così all'anione fluorenile; in tal modo anche quest'ultimo anello diviene localmente aromatico, rendendo tale l'intero ione molecolare,[3] che presenta un totale di 14 elettroni π.[4] Il nome del fluorene non ha a che fare con il fluoro, ma si deve al fatto che i suoi campioni che si prepararono inizialmente mostravano fluorescenza violetta nel visibile, che però, come si vide in seguito, era dovuta a impurezze.[5][6] Caratteristiche generaliA temperatura ambiente e pressione atmosferica si presenta sotto forma di cristalli incolori, dal debole odore simile al naftalene.[7] È praticamente insolubile in acqua (≈ 0,2 mg/100 g a 25 °C), mentre è molto solubile in benzene, etere, piridina e solfuro di carbonio; sebbene meno, si scioglie abbastanza anche in acetone, alcool e tetracloruro di carbonio.[8] La molecola del fluorene è quasi planare,[9] infatti ognuno dei due anelli benzenici è complanare con il carbonio centrale (il numero 9).[10] ProprietàPur essendo un idrocarburo, il fluorene presenta una certa polarità nella molecola: il momento dipolare dedotto teoricamente per esso è pari a 0,50 D; la separazione energetica tra l'HOMO e il LUMO ammonta a 5,04 eV.[3] Il fluorene è un idrocarburo relativamente acido, una caratteristica connessa al fatto che la rimozione di un protone (H+) dal carbonio-9 rende aromatico l'anello pentaatomico, con la stabilizzazione che ne consegue di tutto lo ione molecolare così formato, l'anione fluorenile (C13H9−).[11] A tal proposito, per il fluorene in soluzione di dimetilsolfossido si misura un pKa di 22,6.[12] Tale valore, estrapolato in soluzione acquosa, viene riportato come corrispondente a 22,9.[13] Il fluorene, che si può considerare come un ciclopentadiene con due anelli benzenici condensati, risulta molto meno acido acido del ciclopentadiene stesso (pKa = 18,1), mentre per l'indene (benzociclopentadiene) si ha un valore intermedio, pKa = 20,1.[13] L'anione fluorenile, analogo a quello del ciclopentadienile (Cp), come quest'ultimo può fungere da ligando in complessi metallici del tipo dei metalloceni, alcuni dei quali sono usati come catalizzatori.[14] L'anione fluorenile, che ha un intenso colore arancio, è un buon nucleofilo e molti elettrofili reagiscono con esso dando derivati 9-fluorenilici. La purificazione del fluorene sfrutta la sua acidità e la bassa solubilità del suo sale di sodio (NaC13H9) in idrocarburi. Inoltre, possono essere rimossi dal carbonio-9 anche entrambi i protoni. Ad esempio, il 9,9-dipotassio-fluorenile (K2C13H8) può essere ottenuto trattando il fluorene con potassio metallico in diossano bollente.[15] Usi e produzioneViene in genere ricavato dal catrame di carbon fossile, ma può essere prodotto anche tramite deidrogenazione del difenilmetano.[16] Un'altra via consiste nella riduzione con zinco del fluorenone,[17] o anche tramite il sistema acido ipofosforoso−iodio.[18] Il fluorene è usato nella produzione di medicine, tinture e poliammidi aromatiche. I composti derivanti dal fluorene hanno molte applicazioni. L'acido 9-fluorenoico, un acido carbossilico, è usato nella preparazione di farmaci. Il 2-amminofluorene, il 3,6-bis(dimetilammino)fluorene e il 2,7-diiodofluorene sono usati nei processi di produzione di coloranti. L'ossidazione del fluorene dà il fluorenone, che viene nitrato per dare composti commercialmente utili. Il 9-fluorenilmetil-cloroformiato è usato in ambito di sintesi peptidica per introdurre il gruppo protettivo Fmoc[19] sui gruppi amminici per trasformarli, dopo eliminazione di HCl, in carbammati di 9-fluorenilmetile, che sono resistenti in ambiente acido.[16] Il fluorene dà origine anche a dei polimeri (il polifluorene). Nel polifluorene il carbonio 7 di una unità è legato al carbonio 2 di un'altra unità, al netto di due atomi di idrogeno;[20] questo polimero è capace di condurre elettricità e ha proprietà di fotoluminescenza e di elettroluminescenza, e per questo è stato a lungo studiato per applicazioni quali gli OLED (Organic Light-Emitting Diode). TossicitàGli studi effettuati su ratti (esposti a 0, 125, 250 o 500 mg/kg al giorno per 13 settimane) evidenziano: incremento della salivazione, ipoattività; la percentuale di presenza dei seguenti sintomi è correlata alla quantità somministrata. Ad una concentrazione elevata è stata registrata una difficile respirazione e blefaroptosi (palpebre cadenti).[21] Nelle femmine trattare con 250 mg/kg/giorno di fluorene, si registra un significativo calo dei globuli rossi, diminuzione dell'emoglobina ed un incremento dei livelli di bilirubina. Tuttavia questi sintomi, anche se dipendenti dalla quantità somministrata, non sono statisticamente significativi. Uno studio effettuato da Wilson nel 1947 sugli aspetti cancerogeni del fluorene ha introdotto varie concentrazioni del composto nella dieta di due gruppi di ratti albini. Una parte dei ratti fu esposta ad elevate concentrazioni (tra lo 0,062% e l'1%) per 104 giorni. Si registrò una significativa riduzione della loro velocità di crescita, ma per altri aspetti, nulla di significativo.[21] Alla seconda parte dei ratti, fu somministrata una percentuale di fluorene oscillante tra i 0,125% e lo 0,5% nella dieta per 453 giorni e solo un ratto sviluppò un piccolo adenoma tubolare benigno ad un rene.[21] Il numero totale di animali esaminati non fu indicato. Gli studi effettuati su gatti mostrano una diminuzione di peso (sia per i maschi che per le femmine), per dosi elevate sono stati registrati danni alla milza e ai reni, accompagnati da un aumento istopatologico della quantità di emosiderina nella milza e nelle cellule di Kupffer del fegato.[21] Inoltre, dopo sette iniezioni sottocutanee di 10 mg di fluorene in dieci gatti, non si trovano siti tumorali.[22] Immagini 3D della molecola  Note
Voci correlateAltri progetti
Collegamenti esterni
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||