|
Bicarbonato d'ammonio
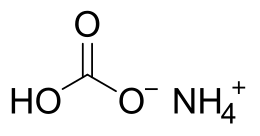
Il bicarbonato d'ammonio (o idrogenocarbonato d'ammonio) è un sale acido dell'ammoniaca e dell'acido carbonico, avente formula NH4HCO3 o [NH4]+[HCO3]−. ProprietàIl bicarbonato di ammonio è un composto salino termodinamicamente molto stabile, ΔHƒ° = -849,4 kJ/mol,[2] ma molto poco stabile cineticamente. A temperatura ambiente si presenta come un solido incolore o polvere bianca dall'odore lieve di ammoniaca. Si può preparare passando un flusso di CO2 in soluzione acquosa di idrossido di sodio; raffreddando la soluzione si separa il sale, che si può ricristallizzare e ottenere come cristalli rombici incolori.[3][4] È molto solubile in acqua, dove si scioglie assorbendo calore (processo endotermico) e la sua soluzione acquosa è debolmente basica. È praticamente insolubile in alcool, acetone ed acetato di etile.[4] A temperature superiori a 35 °C si decompone producendo fumi di ammoniaca: NH4HCO3 → NH3 + CO2 + H2O Reagisce velocemente con acidi, basi forti e forti ossidanti. Con acidi, dalla reazione si producono i corrispondenti sali di ammonio, oltre ad anidride carbonica ed acqua: NH4HCO3 + HCl → NH4Cl + CO2 + H2O Reagisce con una mole di base forte come NaOH svolgendo ammoniaca e dando bicarbonato di sodio in soluzione: NH4HCO3 + NaOH → NaHCO3 + H2O + NH3 ↑ La reazione con i solfati dei metalli alcalino-terrosi porta alla precipitazione dei rispettivi carbonati e formazione di solfato di ammonio: CaSO4 + 2 NH4HCO3 → CaCO3 + (NH4)2SO4 + CO2 + H2O Reagisce con gli alogenuri alcalini dando i rispettivi bicarbonati e il corrispondente alogenuro di ammonio: ApplicazioniViene utilizzato nell'industria alimentare come agente lievitante nella preparazione di dolciumi o come regolatore di acidità (ha sigla E503) e viene usato anche negli estintori e come agente di rigonfiamento in materiali plastici porosi. Note
Bibliografia
Voci correlateAltri progetti
|
||||||||||||||||||||||||||||||||||||||||||||||||||