|
Sommeil  Le sommeil est un état modifié de la conscience du monde extérieur (sans perte de la réception sensitive), accompagné d'une diminution progressive du tonus musculaire, survenant à intervalles réguliers. L'alternance veille-sommeil correspond à l'un des cycles fondamentaux chez les animaux appartenant au rythme circadien. Chez l'être humain, le sommeil occupe près d'un tiers de la vie en moyenne. Le terme de narcose est utilisé pour désigner le sommeil artificiel ou provoqué[1], induit par des moyens médicamenteux ou autres. Le sommeil se distingue de l'inconscience (ou coma) par la préservation des réflexes et par la capacité de la personne endormie à ouvrir les yeux et à réagir à la parole et au toucher. Il existe une organisation du sommeil et de ses trois états. Il est question de rythme circadien pour l'alternance entre la veille et le sommeil. Il est question de rythme ultradien pour l'alternance entre le sommeil lent et le sommeil paradoxal. Le sommeil dépend en grande partie de l’activation du noyau ventrolatéral préoptique (VLPO). Deux grands mécanismes participent à la régulation du sommeil, le processus homéostatique, qui dépend de l'accumulation d'adénosine et le processus circadien, orchestré par l’horloge centrale du noyau suprachiasmatique et régulé par la lumière principalement. Les astrocytes du VLPO, des cellules gliales, intègrent les informations de ces deux processus pour adapter les niveaux d’adénosine et activer les neurones promoteurs du sommeil lent du VLPO[2],[3]. Ils inhiberont alors les centres associés à l'éveil, réduisant la production d'histamine et autres substances qui nous tiennent éveillés. Durant le sommeil, une partie des synapses sont remodelées et ce mécanisme pourrait avoir des explications et implications énergétiques, métaboliques, informationnelles et mémorielles[4]. Certaines femmes dorment mal pendant leurs règles (elles sont deux fois plus sujettes aux insomnies que les hommes) et beaucoup d'entre elles durant la ménopause. Les personnes âgées dorment en général moins bien que les jeunes. Les hommes sont deux à trois fois plus susceptibles de souffrir d'apnée du sommeil que les femmes. HistoirePlaton a défini le sommeil comme un « percepteur de vie »[5]. Le philosophe doxographe grec Théophraste avait écrit un ouvrage intitulé Du Sommeil et des Rêves (en grec ancien Περὶ ὕπνου καὶ ἐνυπνίων / perì húpnou kaì enupníōn) au IIIe siècle av. J.-C.[6] ; le poète latin Virgile dans l’Énéide fait référence a un « premier sommeil »[7],[8] : la reconnaissance des différentes phases du sommeil est donc ancienne. Le sommeil, tant sa régulation que son rôle, reste un mystère pendant des siècles. Le développement de l'électroencéphalogramme (EEG) au XXe siècle permet son étude. Dès 1937, le neurophysiologiste américain Alfred Lee Loomis (en) met en évidence cinq phases dans une nuit de sommeil grâce à l'EEG ; il les énonce de A à E[9] :
Nathaniel Kleitman, directeur d'une unité de sommeil à l'université de Chicago, réduit le nombre de phases de sommeil à quatre :
l'ensemble constituant le sommeil lent (SL). Un de ses assistants, Eugene Aserinsky, remarque sur l'électroencéphalogramme des oscillations de grande amplitude, correspondant à des mouvements oculaires, un relâchement du tonus musculaire de la nuque (chez l'être humain qui peut relâcher volontairement ces muscles et ceux du menton), suivi d'une intense activité du cortex cérébral lorsque les sujets amorçaient le quatrième stade. La présence de mouvements oculaires rapides ou MOR (REM, Rapid eye movements en anglais) permet d'assimiler cette phase aux rêves : elle fut alors baptisée « sommeil rapide » ou « paradoxal » en 1961 par le Français Michel Jouvet, alors chercheur au CNRS à Lyon. Depuis 2011, le nombre de stades du sommeil a été réduit à 3. Les stades 1 et 2 correspondent au sommeil léger et le stade 3 correspond au sommeil lent profond. Le besoin de sommeil semble quasiment universelLe sommeil semble présenter des avantages évolutifs puisqu'il a été conservé par la sélection naturelle chez la plupart des espèces à plan d'organisation complexe, bien qu'il semble coûteux pour de nombreux animaux (vulnérabilité aux prédateurs, moindre temps disponible pour la recherche ou à la prise ou le stock de nourriture, à l'accouplement ou aux soins aux petits, etc.[10]). Jusqu'au début des années 2000, aucun animal sauvage ne dormant pas du tout n'avait été observé dans le monde ; tout laissait donc penser qu'aucun animal ne pouvait vivre longtemps sans sommeil (même chez des animaux pratiquant le sommeil unihémisphérique — demi-sommeil avec un demi-cerveau éveillé et un demi-cerveau endormi — telles les espèces d'oiseaux volant longtemps ou migrant et les mammifères marins pélagiques pour leur permettre la respiration pulmonaire et leur éviter la noyade[11]). Des observations d'orques et de grands dauphins ont légèrement nuancé cette affirmation : le professeur Jerry Siegel et ses collègues de l'université de Californie à Los Angeles (UCLA) ont en effet noté que le mois suivant leurs accouchements, les femelles orques et leurs petits ne dorment pas. Ceci permettrait aux petits d'échapper aux prédateurs, de maintenir leur température corporelle dans l'attente de la graisse protectrice, de remonter très souvent à la surface pour respirer, toutes les 3 à 30 secondes, et de favoriser la croissance rapide de leur cerveau et de leur corps. Ces femelles et leurs petits (re)trouveront peu à peu un rythme de sommeil « normal ». De plus, certaines mouches des fruits (Drosophila melanogaster) semblent ne presque jamais dormir[10]. Dans le laboratoire où a été mesuré leur temps de sommeil, presque toutes dormaient durant 300 à 600 minutes par jour, mais avec des exceptions : environ 6 % des femelles ne dormaient pas plus de 72 minutes par jour et trois d'entre elles, particulièrement actives, n'ont montré des signes de sommeil que 15, 14 et même 4 minutes par jour, apparemment sans effets pour leur santé (ou en tous cas sur leur durée de vie). Des drosophiles dont le sommeil était empêché (par un séjour dans un tube rotatif) supportaient une réduction de 96 % de leur temps normal moyen de sommeil[10]. Études et recherchesImportance des premiers jours de la vieSelon une étude de l'INSERM[12], la qualité du sommeil est programmée dans les premières années de vie. En déréglant artificiellement l'apport en sérotonine (ce qui est connu pour provoquer des troubles du sommeil) sur des bébés souris pendant 15 jours après leur naissance, les chercheurs ont constaté que ces souris devenues adultes avaient un sommeil fragmenté, instable et peu récupérateur. Ces troubles du sommeil s’apparentent à ceux observés lors d’une phase de dépression. « Ces travaux nous laissent fortement penser que les trois premières semaines de la vie, chez la souris, constituent une période critique pendant laquelle s’installe et se consolide l’impact du système sérotoninergique sur l’équilibre du sommeil et des comportements émotionnels. Une fois que ce système est mis en place, il semble qu'il ne soit plus possible d'agir sur cet équilibre de façon persistante » précise Joëlle Adrien, auteur principal et directrice de recherches émérite à l’Inserm. La microscopie électronique tridimensionnelle a récemment (2016-2017) permis de montrer (chez la souris) qu’une partie des synapses du système nerveux central (les plus petites et les plus « plastiques »), après une phase d’excitation le jour sont sélectivement remodelées la nuit durant le sommeil (la taille de l'interface synaptique est globalement diminuée après le sommeil, d’environ 18 % chez la souris selon Diering et al. (2017)[13],[4] ; Ceci soutient l'hypothèse du sommeil comme temps de renormalisation de la force synaptique globale augmentée par l’apprentissage et la mémorisation dans la journée. Les synapses subissent des changements dans les récepteurs du glutamate lors du cycle sommeil-veille, conduit par le gène Homer1a[4]. Chez les animaux éveillés, Homer1a s'accumule dans les neurones mais non dans les synapses occupées par des taux élevés de noradrénaline. Au début du sommeil, la noradrénaline diminue, permettant à Homer1a d’agir dans les synapses excitatrices et – pour les plus petites – de les « affaiblir ». Ce mécanisme pourrait avoir des explications et implications énergétiques, métaboliques, informationnelles et mémorielles[4]. Importance de l'heure du coucherElle semble avoir une influence sur le système immunitaire, ce qui ne serait pas le cas de la durée du sommeil. Dans une étude de 2010, les sujets se couchant tard (vers 2-3 h du matin) avaient un taux de lymphocytes inférieur de 24 % à celui de ceux se couchant plus tôt (entre 23 h et minuit). Le taux de granulocytes de ceux se levant tard était également 18 % plus élevé que celui des sujets se levant tôt[à développer][14]. Les adolescents se couchant après minuit auraient plus de mal à contrôler leurs impulsions. Parmi les facteurs liés à un coucher après minuit figurent l'âge, un nombre important d'heures passées à regarder des écrans (smartphone, ordinateur, tablette, télévision, etc.) et l'absence de participation à une activité parascolaire[15], sportive notamment. Une étude sur les centenaires a noté que tous se couchaient tôt le soir, n'avaient pas de problèmes pour s'endormir, se réveillaient tôt le matin, faisaient une sieste l'après-midi et ne prenaient pas de somnifères. Ainsi, la quantité et les habitudes de sommeil pourraient avoir une grande influence sur la longévité[16]. Importance de la température et de sa régulationOn sait que modifier la température corporelle peut améliorer ou perturber le sommeil chez l'humain ou l'animal[17],[18]. Diverses études ont montré que le sommeil est chez l'animal à sang chaud — dont l'humain — étroitement lié au rythme circadien de la température corporelle centrale (TCC)[19],[20], et cette TCC est elle même régulée par des variations des températures cutanées distales (mains et pieds notamment) qui diminuent naturellement durant le sommeil, mais ces mêmes études ou d'autres (sur le modèle animal) montrent aussi que réchauffer légèrement les mains ou les pieds avant l'endormissement facilite le sommeil[17],[21]. Réchauffer passivement le corps de patients atteint de démence vasculaire (associée à une perte de rythme circadien) augmente la perte de chaleur par les extrémités et corrélativement améliore l'initiation du sommeil[22] ; et le suivi du gradient de température cutanée dit disto-proximal (entre le centre et les extrémités) permet même de prédire la somnolence ; ce paramètre est bien corrélé à la latence du sommeil[23],[24]. Le rythme circadien de la température cutanée distale (dans les pieds & mains) évolue de manière inverse de celui de la température centrale[25],[26]. On avait déjà montré que réchauffer la peau abdominale accroit le flux sanguin cutané et à distance la température des pieds et des doigts ...d'où le nombre de calories perdues dans l'environnement augmente alors[27]. Il est aussi démontré que le syndrome des pieds et mains froids dû à une vasoconstriction des extrémités s'accompagne d'une dégradation du sommeil[28],[29],[30], alors qu'administrer des agents mélatoniques[31],[32] et d'hypnotiques benzodiazépines[33] à ces patients réchauffe la peau des mains et des pieds (ce qui est normalement associé à une perte de chaleur pour l'organisme, et à l'induction d'une phase de sommeil). La zone périoculaire semble être particulièrement sensible à la température extérieure : chez les adultes présentant une légère difficulté à s'endormir, la réchauffer de quelques degrés (2-3 °C) au coucher améliore la qualité subjective du sommeil[34],[35] et augmente la puissance des ondes delta lors du sommeil[35]. Une étude récente (2019) a confirmé que réchauffer passivement la zone périoculaire durant 20 min (avec un masque chauffant à 38–40 °C) améliore l'endormissement et la qualité de sommeil (objective et subjective) chez les adultes ayant de légères difficultés à s'endormir, en induisant une somnolence subjective et en apportant une sensation agréable. Cet effet pourrait être lié à une perte de chaleur induite dans les mains et pieds[36]. Durée du sommeilChez les mammifèresElle varie beaucoup selon l'espèce, l'âge de l'individu et la saison (chez les hibernants notamment). Le tamia passe environ quinze heures par jour les yeux fermés alors que la girafe en passe elle seulement quatre et demie[réf. nécessaire]. Selon Jerome Spiegel, chercheur à l'université de Californie à Los Angeles, chaque espèce se serait adaptée pour gérer au mieux ses dépenses énergétiques et assurer sa sécurité. Les éléphants dorment à peine plus de trois heures par jour. Il est logique, sur le plan évolutionnaire, que les petites chauves-souris brunes économisent leur énergie, sauf lors des quelques heures par nuit où les insectes dont elles se nourrissent sont de sortie. Un ornithorynque peut dormir plus (quatorze heures), peut-être parce qu'un repas frugal de crustacés suffit à lui apporter une dose suffisante de calories. Quant à la question de sécurité, les mammifères qui dorment dans une cachette, comme les chauves-souris ou les rongeurs, ont tendance à faire des sommes plus longs et plus profonds que ceux devant rester constamment en alerte[37]. Le besoin de sommeil est une notion individuelle variant de six heures à dix heures par nuit pour les « gros dormeurs ». Chez l'humainLes besoins varient selon l'âge et le degré de fatigue induit par les activités diurnes. L'adulte moyen a besoin de huit heures de sommeil par nuit[38]. Le sommeil monophasique (nuit de sommeil effectuée d'une seule traite) qui est commun aujourd'hui serait une conséquence de l'industrialisation et de l'éclairage artificiel. Le psychiatre Thomas Wehr (en) a montré[39],[40] qu'à l'abri des éclairages artificiels et une fois la dette de sommeil payée, le sommeil de l'être humain se stabilise sur un cycle inhabituel aujourd'hui de deux périodes de sommeil (sommeil biphasique) entrecoupées d'une période de « dorveille », terme utilisé au Moyen Âge pour désigner l'état de conscience entre sommeil et éveil[41]. Le sommeil polyphasique s'effectue en plusieurs périodes durant une journée, et non en une seule « nuit », ce qui permettrait d'en réduire la durée totale, jusqu'à pouvoir se contenter de deux à cinq heures par journée [réf. nécessaire]. D'après l'historien Roger Ekirch, qui étudie les habitudes de sommeil de l’ère pré-moderne (1500-1750), la pratique de l'époque est d'avoir un premier repos après le dîner, puis une à deux heures d’éveil vers minuit et enfin un nouveau temps de sommeil avant le matin[42]. La pratique de la nuit de huit heures d'une traite n'apparaît pas avant la fin du XVIIe siècle[42]. Les moins de 65 ans ne dormant que 5 heures ou moins chaque nuit ont un taux de mortalité 65 % plus élevé que ceux qui dorment 6 ou 7 heures par nuit, mais selon une étude récente (2018), un manque de sommeil durant une semaine à 5 heures de sommeil par nuit, peut néanmoins être « rattrapé » le week end en dormant plus de 8 heures durant chacune de ces deux nuits[43]. Les Australiens seraient les plus grands dormeurs du monde, avec une moyenne de neuf heures par nuit, tandis qu'un Asiatique sur deux dort moins de six heures[44]. Une étude menée aux États-Unis suggère que la durée moyenne du sommeil est légèrement plus courte pour les hommes que pour les femmes, et pour les Noirs que pour les Blancs[45]. En France, l'insuffisance de sommeil est bien installée et les Français accumulent une dette de sommeil. En 2009, le temps de sommeil moyen en France est d'un peu moins de sept heures en semaine et de 7 h 50 en moyenne le week-end, soit une réduction de près d'une heure et demie depuis un demi-siècle[46]. Une étude plus récente (2012) indique que la durée moyenne quotidienne de sommeil des français est de 7 h 5 min en semaine et 8 h 11 min le week-end[47]. Techniques d'étudeLes méthodes d'exploration du sommeil sont nombreuses. Dans les centres du sommeil, l'examen de base est la polysomnographie qui regroupe l'enregistrement de plusieurs variables :
Le test itératif de latence à l'endormissement (TILE) permet de mesurer le temps nécessaire pour s'endormir. Il est utilisé pour faire le diagnostic de certains troubles du sommeil. L'agenda du sommeil est un test simple qui ne coûte rien. Il permet d'analyser le sommeil et d'orienter assez facilement le diagnostic en cas d'insomnies. CausesLe sommeil était considéré comme naturellement induit par l'arrêt de sécrétion d’histamine, le neurotransmetteur qui permet au cerveau de rester en éveil. Il s'agissait de la théorie dite « passive » pour laquelle la formation réticulée jouait un rôle prépondérant et qui considérait que le sommeil n'était que l'arrêt de l'éveil. L'endormissement résulte de mécanismes actifs dit « permissifs »[48]. La régulation de l'alternance veille-sommeil est contrôlée par un double processus : homéostatique et circadien. D'une part le processus circadien (véritable horloge biologique interne), s'aligne sur l'alternance du jour et de la nuit (le rythme nycthéméral), au moyen des facteurs externes de synchronisation. Le rythme nycthéméral s'exprime dans l'ensemble de l'organisme par une baisse de la température, grâce à une hormone cérébrale, la mélatonine, qui est synthétisée durant la nuit par la glande pinéale. L'horaire de sécrétion de cette hormone dépend en partie de facteurs génétiques (sujets du soir ou du matin), mais est également modulée par les stimuli extérieurs tels que la luminosité, l'apport alimentaire, la production de chaleur et l'entraînement social. D'autre part le processus homéostatique (la tendance à retourner vers un état d’équilibre) est une sorte de chronomètre qui fait alterner les périodes d'éveil et de sommeil. La propension au sommeil augmente progressivement au cours de la journée, pour ensuite se dissiper au cours de la nuit, pendant le sommeil. Les mécanismes moléculaires à l'origine de ce processus homéostasique ne sont toutefois pas encore connus. En pratique, la somnolence et le sommeil surviennent donc à cause de l'effet synergique de deux facteurs : éveil prolongé d'une part, et synchronisation au rythme circadien d'autre part. Il a été montré en 2008[49] que l'exposition à la lumière naturelle améliore les symptômes liés aux troubles des cycles du sommeil, mais les études qui rattachaient la prise orale de mélatonine à un meilleur sommeil sont de plus en plus controversées[50]. Au niveau évolutif, l'hypothèse de Michel Jouvet est que le sommeil est un réflexe archaïque contre la peur du noir[51]. Fonctions du sommeilRepos L'organisme humain se restaure physiquement pendant le sommeil, se guérit et élimine les déchets qui s'accumulent durant les périodes d'activité. Cette restauration a lieu principalement pendant le sommeil lent profond, au cours duquel la température corporelle, la fréquence cardiaque et la consommation d'oxygène du cerveau diminuent. Alors que dans le reste du corps les processus de restauration peuvent avoir lieu aussi bien pendant les phases éveillées qu'au repos, dans le cerveau, ils ne se produisent que durant les phases de sommeil. Dans les deux cas, l'activité réduite du métabolisme permet l'apparition de processus réparateurs et compensateurs[52]. Pendant la veille, le métabolisme produit des dérivés réactifs de l'oxygène (composés chimiques réactifs dotés d'un électron non apparié), qui sont dommageables pour les cellules. Durant le sommeil, les taux métaboliques diminuent et la production de dérivés réactifs de l'oxygène diminue. Cette diminution permet aux processus de restauration de prendre le relais. Le cerveau endormi élimine les déchets métaboliques à un rythme plus rapide qu'à l'état d'éveil[53],[54]. Le sommeil pourrait aider à faciliter la synthèse de molécules qui aident à réparer et à protéger le cerveau de ces éléments nocifs engendrés pendant le réveil[55]. Les hormones anabolisantes telles que les hormones de croissance sont sécrétées préférentiellement pendant le sommeil. Les chercheurs pensent que le sommeil pourrait aider à lutter contre l'accumulation de radicaux libres dans le cerveau, en augmentant l'efficacité des mécanismes antioxydants endogènes[56][source insuffisante]. La concentration du sucre glycogène dans le cerveau augmente pendant le sommeil et est consommé par le métabolisme pendant l'éveil[52]. L'élimination des macromolécules et des protéines extracellulaires notamment des amyloïde β dans le corps se fait au travers du système lymphatique. Ce réseau est absent du cerveau[57]. Des études de 2015 ont cependant révélé qu'un réseau lymphatique est présent à la périphérie du cerveau dans la dure-mère[58]. Des études ont démontré que le liquide cérébrospinal pouvait remplir également le rôle d'élimination des déchets métaboliques notamment grâce aux cellules astrocytes qui participent à la protection des cellules nerveuses et jouent un rôle essentiel dans la circulation du liquide cérébrospinal grâce à leur aquaporine[59]. Le système de circulation du liquide cérébrospinal est appelé système glymphatique[59]. Lors des phases de sommeil, l'espace entre les cellules augmente de 60 % et permet une circulation du liquide cérébrospinal et donc une élimination des toxines deux fois plus rapide que pendant les phases d'éveil[54]. L'activation rapide en quelques minutes de certains gènes notamment dans les cellules nerveuses nécessite des cassures de l'ADN qui rendent celui-ci accessible pour sa transcription. Ces cassures sont ensuite réparées. Ce processus est réalisé par l'enzyme topoisomérase IIβ (en)[60],[61]. L'induction de gènes liés à la plasticité qui nécessite des brisures d'ADN est plus élevée lors de l'éveil que dans le sommeil et le taux de réparation des brisures de l'ADN est plus important lors des phases de sommeil[62]. Il a été démontré que la guérison des plaies était affectée par le sommeil[63]. Il a été démontré que la privation de sommeil affecte négativement le système immunitaire[64]. « Le manque de sommeil altère la fonction immunitaire et un déficit immunitaire modifie le sommeil ». Le sommeil augmente le nombre de globules blancs[65]. Une étude de 2014 a révélé que priver les souris de sommeil favorisait le développement d'un cancer existant et diminuait la capacité du système immunitaire des souris à le contrôler[66]. L'effet de la durée du sommeil sur la croissance n'est pas complètement établi. Des scientifiques ont étudié les corrélations entre croissance, taille et poids, avec le temps passé au lit chez 305 enfants sur une période de neuf ans (de 1 à 10 ans). Il a été constaté que « la variation de la durée du sommeil chez les enfants ne semble pas avoir d'effet sur la croissance »[67]. Il est établi que le sommeil lent profond affecte les niveaux d'hormone de croissance chez les hommes adultes. Pour un sommeil de huit heures, Van Cauter, Leproult et Plat ont constaté que les hommes qui présentaient un pourcentage élevé de sommeil lent profond (24 % en moyenne) avaient un niveau de sécrétion d'hormone de croissance élevé, tandis que chez les sujets présentant un faible pourcentage de sommeil lent profond (moyenne de 9 %) le niveau de sécrétion d'hormone de croissance était plus faible[68]. Fonctions cognitivesLe sommeil participe aux processus de la mémoire[69],[70]. La mémoire procédurale bénéficie des phases de sommeil tardives, riches en sommeil paradoxal. La mémoire explicite bénéficie des phases de sommeil précoces, riche en ondes lentes[71],[72]. La perte de sommeil nuit à la performance des tâches d’attention et de contrôle exécutif[73]. Restauration des tissusLe sommeil joue un rôle crucial dans la restauration des tissus et la réparation des blessures[74]. RêvesAu cours du sommeil, en particulier du sommeil paradoxal, les individus tendent à avoir des rêves. Les rêves peuvent inclure des sensations de tous types, en particulier la vision et le mouvement[75]. Beaucoup d'hypothèses ont été proposées pour expliquer la fonction du rêve. Sigmund Freud a postulé que les rêves sont l'expression symbolique de désirs frustrés qui ont été relégués à l'inconscient et a eu recours à l'interprétation des rêves au cours de psychanalyses pour essayer de découvrir ces désirs refoulés. Contre-intuitivement, les érections péniennes pendant le sommeil ne sont pas plus fréquentes pendant les rêves sexuels que pendant d'autres rêves[76]. Le système nerveux parasympathique présente une activité accrue durant le sommeil paradoxal, ce qui peut provoquer l'érection du pénis ou du clitoris. Chez les hommes, 80 à 95 % du sommeil paradoxal s'accompagne normalement d'une érection partielle ou totale du pénis, alors que seulement 12 % des rêves des hommes contiennent un contenu sexuel[77]. John Allan Hobson et Robert McCarley proposent que les rêves soient causés par le déclenchement aléatoire de neurones dans le cortex cérébral pendant le sommeil paradoxal. Cette théorie pourrait contribuer à expliquer l'irrationalité des rêves pendant les périodes de sommeil paradoxal. Selon cette théorie, le cerveau antérieur créerait une histoire dans une tentative de réconcilier et de donner un sens à l'information sensorielle absurde qui lui est présentée. Cela expliquerait la nature étrange de nombreux rêves[78]. L'utilisation d'antidépresseurs, d'acétaminophène, d'ibuprofène ou de boissons alcoolisées est supposée supprimer les rêves, alors que la mélatonine pourrait les stimuler[réf. nécessaire]. PhasesChez la plupart des individus, lors d'une nuit, trois à cinq cycles de sommeil de 90 minutes environ (c'est une moyenne) peuvent se suivre, chacun se composant de quatre phases distinctes. Les trois premières phases correspondent au Sommeil à Ondes Lentes (SOL), les mesures électriques étant très faibles, et la quatrième au sommeil paradoxal où le sujet rêve. Certaines études scientifiques ont montré que le sujet pouvait aussi rêver dans les autres phases du sommeil. Les données de l'EEG pendant la veille et le sommeil sont communes à tous les mammifères. Par contre, il semblerait qu'il y ait quelques différences chez les mammifères primitifs comme l'échidné. Ces données permettent de distinguer différents stades dans le sommeil. Somnolence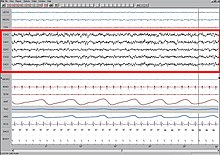 La somnolence (stade 1) est le stade de l'endormissement (transition entre l'éveil et le sommeil) souvent précédé de bâillements. Il est caractérisé par une réduction de la vigilance, du tonus musculaire et de la fréquence cardiaque. Les mouvements musculaires sont lents (les globes oculaires « roulent »). La latence d'endormissement considérée comme normale est inférieure à vingt minutes. Au-delà, il s'agit d'une insomnie. Fait notable, la phase d'endormissement n'est jamais perçue, contrairement au réveil de celle-ci (exemple de l'endormissement lors de la conduite automobile). L'imagerie hypnagogique a souvent lieu pendant la phase I, mais pas toujours[79]. Onde Théta : 3,5 à 7,5 Hz. On parle de somnolence diurne excessive quand elle perturbe la vie du sujet. C'est un syndrome fréquemment associé à l'obésité. Sommeil léger Le sommeil léger (ou stade 2) occupe environ 50 % du temps de sommeil total. Le sujet est assoupi, mais il est encore très sensible aux stimuli extérieurs. Ainsi en stade 2, environ 50 % des bons dormeurs et 80 % des mauvais dormeurs pensent ne pas dormir. Onde Théta (3,5 à 7,5 Hz), complexes K, et fuseaux de sommeil (12 à 14 Hz). Sommeil profond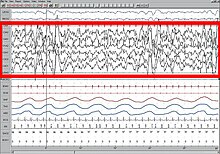 Le sommeil profond correspond au stade 3 : l'activité électrique est constituée d'ondes lentes, les ondes delta (< 3,5 Hz), et les signes vitaux se ralentissent tout en devenant réguliers. Entre le stade 2 et 3 persiste une très discrète activité musculaire et les mouvements oculaires ont quasiment disparu. C'est au stade 3 que peuvent parfois se produire les terreurs nocturnes ou le somnambulisme. C'est à ce moment qu'ont lieu les divisions cellulaires et la production de l'hormone de croissance, d'où l'importance du sommeil chez l'enfant. Le sommeil profond occupe environ 1 heure et 40 minutes au cours d'une nuit moyenne de sommeil, que la personne soit un petit dormeur ou un gros dormeur. Il a tendance à diminuer avec l'âge, au profit du stade 2. C'est la phase la plus importante du sommeil. Sommeil paradoxal Au contraire des autres phases, l'activité électrique du cerveau et des yeux est très importante lors du sommeil paradoxal, alors qu'il existe une atonie musculaire (paralysie) quasi totale du reste du corps, en dehors des mouvements oculaires qui surviennent par saccades. Cette atonie peut disparaitre dans la maladie de Parkinson[réf. souhaitée], où les patients auront tendance à beaucoup bouger dans le sommeil paradoxal. Sur l'EEG, l'activité néocorticale est plus proche de celle de l'éveil que celle du sommeil lent, c'est là le « paradoxe ». La respiration est irrégulière. Le cœur accélère ou ralentit. Chez l'être humain, on observe une dilatation des organes pelviens et une érection qui peut être suivie d'éjaculation. Cette phase se répète toutes les 90 minutes environ, et sa durée s'allonge avec la succession des cycles du sommeil, pour devenir maximale en fin de nuit. C'est la période propice aux rêves, bien que les rêves puissent survenir pendant le sommeil lent. Le sommeil paradoxal correspond environ à 20-25 % du temps total de sommeil. Le souvenir des rêves a longtemps été associé avec la présence de sommeil paradoxal. En réalité, on pense aujourd'hui que nous pourrions rêver au cours d'autres stades[80]. Cela dit, les enregistrements polygraphiques (EEG, EMG et EOG) ont permis de montrer une certaine corrélation entre le rêve et le sommeil paradoxal. Des études ont été faites en réveillant plusieurs individus à différents stades du sommeil. Elles ont montré que la qualité du souvenir qu'ils gardent de leur rêve est fonction du stade auquel ils sont réveillés. En effet, les sujets réveillés au cours de leur sommeil paradoxal se souviennent avec beaucoup plus de détails de leur rêve, alors que si on les réveille au cours du sommeil lent, ils s'en souviennent de façon très floue, ou n'en gardent aucun souvenir précis. Les études ont également montré que l'importance du mouvement oculaire, l'augmentation du rythme cardiaque et l'intensité du rêve sont corrélés. Ces études ont conclu que 80 % des rêves se produisent pendant le sommeil paradoxal. Cependant, les activités oniriques peuvent également avoir lieu pendant certains stades du sommeil lent. Il ne faut donc pas superposer les termes « rêve » et « sommeil paradoxal ». Hypnogramme Au cours d'une nuit de sommeil, les périodes de sommeil paradoxal s'allongent de plus en plus. Au contraire, les phases de sommeil lent profond (stades 3 et 4) se raccourcissent et disparaissent, au profit du stade 2. L'hypnogramme permet de visualiser ces différents stades. À la fin de chaque cycle, il existe, de façon tout à fait normale, des brefs réveils, en général moins de trois minutes, dont la personne ne se souvient pas le matin. Cependant, certaines personnes ne se souviennent que de ces éveils et croient à tort qu'elles n'ont pas fermé l'œil de la nuit[81]. En vieillissant, les périodes de réveil sont mieux mémorisées[Quoi ?], donnant l'impression d'un mauvais sommeil alors que la durée de celui-ci est inchangée[82]. Lorsque surviennent des réveils inopinés, le sujet doit repasser en sommeil 1, puis 2 puis 3 et 4. Ainsi, les personnes souffrant d'apnée du sommeil ne dépassent guère le stade 2 du fait des réveils fréquents induits par l'hypoxie. Le sommeil est donc de mauvaise qualité, responsable d'accès de somnolence diurne. États fonctionnels du cerveau
Continuum conscience-inconscienceIntrusion de la conscience dans le sommeilLe sommeil n'est pas uniforme, il est constitué de différentes phases. Elles ne sont pas obligatoirement présentes au cours d'une nuit de sommeil. Cette liste récapitule ces différentes formes de conscience[84].
Intrusions du sommeil dans l'état d'éveilSelon les données disponibles au début des années 2020, ces intrusions (parfois pathologiques) semblent toucher différentes aires cérébrales, et se manifestent alors par des sensations diverses de type « vagabondages de l'esprit » à des sensations a posteriori de « vide mental », de « trou »… Ces « intrusions » sont souvent corrélées avec des troubles du sommeil quand elles sont anormalement fréquentes et/ou longues. La recherche a récemment montré que, de manière inattendue, les personnes TDA/H ne sont pas caractérisés par plus de vagabondages de l'esprit que le sujet non TDA/H, mais par plus de « blancs », d'épisodes de vide mental ; on a aussi montré que le nombre d'ondes lentes observées durant l'éveil chez les adultes TDA/H est nettement plus élevé que chez les individus épargnés par ce trouble[85]. Selon Thomas Andrillon (INSERM, Institut du cerveau), les mécanismes de régulation de la vigilance et de l'attention pourraient être identiques, avec une diminution de la quantité de noradrénaline et de dopamine provoquant une augmentation de la fréquence des ondes lentes, qui, selon son importance, ferait passer le cerveau d'un état très éveillé à un état où il est localement endormi, ce qui serait le cas dans le TDA/H, ou complètement endormi, comme dans la narcolepsie ; ceci expliquerait que la Rilatine (molécule psychostimulante) soit paradoxalement efficace contre l'hyperactivité et l'impulsivité[85]. Des mises en sommeil temporaires de certaines parties du cerveau semblent fréquentes, et contrairement à une idée reçue, un déficit de sommeil ne fait pas que ralentir l'accomplissement des tâches, le cerveau peut alors être le lieu de variations entre des moments de perte d'attention et au contraire d'hyperactivité ou de réponses impulsives ; deux réponses qui pourraient correspondre à des intrusion de sommeil en des endroits différents du cerveau (ex. : le cortex préfrontal en cas d'hyperactivité et d'impulsivité)[86]. PathologiesChiffres notablesD'après le rapport sur le thème du sommeil[87] : La somnolence diurne excessive atteint 8 % de la population française, 20 à 30 % de la population souffre d'insomnie peu sévère, 5 à 15 % de la population souffre d'insomnie sévère, 15 à 20 % des adultes utilisent occasionnellement des somnifères, 10 % en font un usage régulier. La somnolence diurne et les hypersomnies sont moins bien connues. Chez les 30-60 ans, 9 % des hommes souffrent du syndrome d'apnées du sommeil, contre 4 % chez les femmes. D'après une étude réalisée par l'IFOP en mars 2022[88] :
Conséquences ou corrélationsLes insomnies ou le manque volontaire ou imposé de sommeil réparateur peuvent avoir de nombreuses conséquences sociales, sanitaires et psychosociales[87], avec de larges conséquences pour la société :
Un sommeil trop court ou trop long ou de mauvaise qualité semble corrélé à :
ClassificationPlusieurs formes de dysfonctionnement du sommeil sont dénombrées, selon leurs manifestations et l'état de veille du sujet. L'âge et l'état de santé du sujet, l'absorption de substances médicamenteuses ou d'excitants, les conditions climatiques et de luminosité, la relation du sujet à l'espace et au temps, sont autant de causes potentielles des insomnies. L'utilisation d'appareils électroniques peu avant le coucher est aussi une cause potentielle des insomnies[100]. Les troubles du sommeil se répartissent en deux catégories : les parasomnies qui sont des manifestations qui accompagnent le sommeil, pouvant le perturber ou non, et les dyssomnies qui consistent en une altération de la quantité ou de la qualité du sommeil. Effets de l'utilisation des appareils électroniques sur le sommeilEffets de la lumière bleueL’utilisation d’appareils électroniques, tels que les ordinateurs, les télévisions, les téléphones intelligents, les consoles de jeux vidéo et les liseuses, avant le coucher, affecte le sommeil. Plus précisément, ces derniers affectent le rythme circadien. Celui-ci est régulé par plusieurs zeitgebers, dont un des plus importants est la lumière[101]. La raison pour laquelle la lumière (et l’absence de celle-ci) a un rôle primordial dans l’horloge circadienne est qu’elle dicte tous les autres rythmes environnementaux, alors c’est la source la plus fiable concernant le moment de la journée[101]. Les appareils électroniques agissent donc comme une source artificielle de lumière. En effet, les appareils électroniques de nos jours utilisent des LEDS (light-emitting diodes) émettant de la lumière blanche[102]. Cette lumière blanche provient d’une source bichromatique, soit la combinaison de LED bleu (450-470 nm) et jaune (⁓ 580 nm), qui sont des lumières avec des longueurs d’onde complémentaires[103]. L'œil humain est sensible à la lumière bleue, plus spécifiquement un des trois photorécepteurs composant la rétine des mammifères l’est[104]. Ce dernier est le ipRGCs (intrinsically photosensitive retinal ganglion cells), qui a un spectre d’absorption autour de 470-480 nm[104]. Puis, ce type de photorécepteur participe à la synchronisation de l’horloge circadienne[105] et donc ils affectent indirectement le sommeil. Le photopigment associé à ce photorécepteur, soit la mélanopsine, est aussi sensible à la lumière bleue et elle est liée au NSC et donc au sommeil[104],[106]. En effet, la mélanopsine module les effets de la lumière bleue sur le cerveau[107]. Ainsi, lorsque la lumière bleue atteint la rétine de l'œil entre le crépuscule et l’aube, celle-ci va activer les neurones qui régulent le cycle du sommeil tout en activant des neurones d’orexien qui eux vont exciter l’hypothalamus[107]. De plus, la lumière bleue fait partie des quelques stimuli qui affectent le cycle de sécrétion de la mélatonine dans le cerveau[108]. Étant donné que la mélatonine joue un rôle très important dans la régulation du cycle circadien et sur le sommeil[108], la lumière bleue vient indirectement perturber ceux-ci. En effet, la sécrétion de mélatonine est synchronisée presque parfaitement avec les heures de sommeil, c’est-à-dire lorsque la nuit tombe[108]. L’effet de la mélatonine sur le sommeil survient après une succession de modifications dans le cerveau[108]. Celle-ci modifie les niveaux de neurotransmetteurs monoamine dans le cerveau qui vont ainsi causer une multitude de réactions enzymatiques[108]. Ces réactions vont à leur tour activer les mécanismes impliqués dans le sommeil[108]. Impacts de l'utilisation des appareils électroniquesIl existe trois différentes façons en quoi l’utilisation d’appareils électroniques affecte la qualité du sommeil[109]. En premier lieu, l’exposition à de la lumière vive émise par les divers appareils électroniques réprime la sécrétion naturelle de la mélatonine, repousse le début du sommeil et interrompt ce dernier[110]. Le second mécanisme est le décalage des heures de sommeil, plus fréquemment observé chez les enfants et les adolescents[111]. Troisièmement, le contenu observé sur les appareils électroniques peut induire différentes réactions chez l’individu, telles que du stress, entraînant une difficulté à s’endormir ou une qualité de sommeil moindre[112]. De nombreux ouvrages ont identifié de multiples conséquences négatives liées à une surutilisation des téléphones cellulaires chez les jeunes[113]. Il y a notamment la baisse de la qualité des performances académiques[114], une diminution de la qualité du sommeil[115], une détérioration de la santé mentale[116], une tendance plus élevée à adopter un mode de vie sédentaire, une diminution de l’activité cardio-respiratoire et une réduction de l’intensité dans les activités sportives pratiquées[117] ainsi qu’une diminution généralisée du niveau de satisfaction de la vie[117]. Une étude de Van den Bulck, réalisée en 2007, explique qu’un adolescent flamand sur cinq signale envoyer et/ou recevoir des SMS au moins une fois par semaine après avoir éteint la lumière et 15,2 % d'entre eux ont envoyé et/ou reçu plus de dix messages par nuit[118]. Lors de cette même étude, il a été constaté que ceux qui utilisaient des téléphones portables après l’élimination des sources lumineuses au moins une fois par mois étaient deux fois plus susceptibles de se sentir très fatigués un an plus tard, par rapport à ceux qui n’avaient pas cette habitude[118]. Pour ceux qui déclaraient utiliser leur téléphone cellulaire environ une fois par semaine après avoir éteint les lumières, les probabilités qu’ils se sentent fatigués étaient trois fois plus élevées, tandis que chez ceux qui l’utilisaient plusieurs fois par semaine les probabilités étaient cinq fois plus élevées[118]. Une autre étude réalisée par Munezawa et al. en 2011 a analysé l’impact de l’utilisation du téléphone portable sur le sommeil de 95 680 étudiants japonais allant à l’école secondaire[115]. Parmi l’échantillon, 18 % ont indiqué utiliser leur téléphone portable tous les jours après avoir éteint les lumières[115]. Il est à noter que la fréquence d'utilisation était plus élevée chez les élèves plus vieux que chez les plus jeunes[115]. L'utilisation du téléphone portable après la fermeture des lumières est associée à des nuits écourtées, une moins bonne qualité de sommeil, plus de somnolence diurne et des symptômes d'insomnie[115]. De plus, plusieurs études ont découvert des effets néfastes des champs électromagnétiques émis par les téléphones sur les électroencéphalogrammes du sommeil et le temps d'apparition de la mélatonine[119]. Pour ce qui est des adultes, la littérature à ce sujet suggère que ce sont différents procédés qui sont engendrés par la lumière émise par les appareils électroniques[109]. Par exemple, alors que l'utilisation des appareils électroniques est généralement associée avec un sommeil déficient, pour les adultes, elle constituerait un mécanisme d’adaptation au manque de sommeil[109]. Une étude parmi les jeunes adultes a trouvé que l'utilisation des médias était un résultat et non une cause de troubles du sommeil[120]. Les auteurs ont émis l'hypothèse que les adultes peuvent utiliser les médias comme moyen pour faire face à leurs problèmes de sommeil[120]. De plus, l'utilisation des médias entraîne souvent une durée de sommeil plus courte chez les enfants et les adolescents, couramment appelé le syndrome de retard de phase du sommeil[121]. Des études chez les adultes ont trouvé des preuves de décalage dans le temps, un phénomène par lequel l'utilisation des médias coïncide avec des heures de coucher et de lever plus tardives[122]. La conclusion est que l’utilisation d’appareils n’aurait aucun impact sur la durée totale du sommeil des adultes[122]. L’étude d’Exelman et Van den Bulck réalisée en 2015 vise à examiner comment l'utilisation du téléphone mobile repousse le sommeil dans un échantillon d’adultes entre 18-94 ans[109]. Les résultats de cette étude supportent en partie celles de la littérature car elle a démontré que l’utilisation d’appareils électroniques chez les adultes entraînait de l’insomnie, une moins bonne qualité de sommeil ainsi que de la fatigue tout comme chez les jeunes et adolescents[109]. Cependant, il n’y aurait pas d’impact sur l’heure du coucher, mais elle retarderait l’heure du lever[109]. Il est à noter que d’autres études devraient être menées sur le sujet pour mieux comprendre les impacts d’une surutilisation des appareils électroniques, car il y a beaucoup de facteurs qui influencent l’utilisation des appareils électroniques en fonction de l’âge tels que les études, le temps et type de travail ainsi que la vie familiale)[109]. L’étude de Li et al. réalisée en 2015 a analysé comment le locus de contrôle influence l’utilisation du téléphone portable d’étudiants n’ayant pas terminé leurs études ainsi que les conséquences de leur utilisation[113]. En résumé, le locus de contrôle constitue la croyance d’une personne quant à sa capacité à contrôler l’environnement ainsi que la résultante de ses agissements[113]. Les individus ayant un locus interne plus important ont tendance à croire qu’ils sont responsables des conséquences de leurs actions alors que ceux avec un locus externe dominant ont plutôt tendance à attribuer les résultats de leurs comportements à des facteurs extérieurs[113]. Cette même étude a démontré que les personnes avec un locus de contrôle à tendance externe éprouvent plus de difficulté à contrôler l’utilisation de leur téléphone cellulaire[113]. En d’autres mots, les personnes ayant un locus de contrôle externe ont plus tendance à utiliser leur appareil électronique à l’heure du coucher, pendant les cours ou même pendant une séance d’étude[113]. Par conséquent, ces personnes deviennent plus vulnérables face aux impacts d’une utilisation excessive du téléphone cellulaire, résultant soit en une mauvaise qualité du sommeil, un rendement scolaire réduit et une diminution du bien-être général[113]. D'autres études ont également confirmé que les attributs psychologiques d’une utilisation élevée du téléphone mobile tels que le besoin d'être facilement rejoint sont liés aux troubles du sommeil[123]. Somnolence et conduite Source: Federal Motor Carrier Safety Administration[124] La conduite avec somnolence concerne 10 à 15 % des conducteurs professionnels et représente le tiers des causes de décès liés aux accidents de la route sur les autoroutes françaises[125]. Les causes de ces somnolences peuvent être variées : travail à horaires irréguliers, privations chroniques de sommeil notamment[125]. En Europe, la somnolence au volant est l'une des causes majeures des accidents de la route[125]. Toutefois, cette cause est difficile à établir : le conducteur ne se rappelle pas sa somnolence, peu de faits matériels permettent d'établir la somnolence, la somnolence peut induire un changement de direction ainsi qu'une absence de freinage augmentant la gravité de l'accident[125]. Toutefois, la somnolence n'est pas identifiée comme un facteur de risque, ni par les statistiques européennes, ni par les forces de l'ordre[125]. Différents véhicules (TGV, automobiles) contiennent des dispositifs commercialement valorisés susceptibles de détecter la somnolence du conducteur, alors qu'aucune autorité centrale n'a établi un protocole de test harmonisé[125]. La société occidentale et sommeilÂge et sommeilDu point de vue de l'évolution, le sommeil est une phase durant laquelle l'être humain est très vulnérable. Comme chez d'autres espèces, l'homme est vulnérable aux prédateurs lorsqu'il est inconscient et endormi. Pour minimiser le risque d'être attaqué pendant le sommeil, certains individus veillaient en groupe. Ainsi, une partie de l'ensemble du groupe s'est endormie tardivement parce qu'elle avait monté la garde auparavant. En revanche, une autre partie du groupe s'est levée tôt pour réveiller la partie endormie en cas d'incident. C'est une explication possible du fait que certains se lèvent tôt et d'autres pas[126]. Un résidu de cette vulnérabilité pendant le sommeil se reflète dans la société concernant le traitement des personnes dormant. Alors qu'il est considéré comme normal et même recommandé de veiller sur un enfant en bas âge, ce n'est pas bien vu de le faire chez des adultes en bonne santé. Le fait d’être surveillé ou observé pendant le sommeil est considéré comme un manque d'autonomie de l’individu dans la société. Lors de problèmes de santé, comme la maladie et/ou la vieillesse, il est socialement plus accepté de se faire surveiller durant le sommeil[127]. De la même manière que le sommeil est traité dans différents groupes d'âge, les activités avant le coucher varient. En 2011, the National Sleep Foundation a mené une enquête auprès d’Américains concernant l'utilisation d'appareils électroniques avant d'aller se coucher. 90% des personnes interrogées ont confirmé qu’ils utilisaient des appareils électroniques, par exemple le portable, avant d’aller dormir. Cette utilisation diminue avec l'âge, passant de 66% chez les jeunes adultes à 30% chez les personnes d'âge moyen et à 20% chez les personnes âgées. L'utilisation d'appareils électronique engendre des problèmes d'endormissement et une baisse de la qualité du sommeil[128]. Le sommeil une grande variationDepuis des décennies, il y a plusieurs études[128] des médecins qui affirment que les femmes et les hommes ne dorment pas de la même manière. Les femmes ont tendance à moins dormir, à avoir des problèmes de sommeil plus fréquents et à souffrir d'insomnie. Toutes tranches d'âge confondues, entre 17,7% et 25,1% des femmes déclarent avoir des problèmes de sommeil. Comparativement, les hommes sont moins nombreux à déclarer des problèmes de sommeil (entre 13,7% et 18,1%). La même tendance se retrouve dans la question de savoir si la population est fatiguée tout au long de la journée. L'évaluation des hommes montre que 16,4% à 22,9% d'entre eux ressentent de la fatigue pendant la journée. Les valeurs des femmes sont à nouveau plus élevées, avec 20,5% à 29,9%[128]. FemmeLes problèmes de sommeil sont des phénomènes courants pendant la grossesse, en particulier au cours du premier et troisième trimestre. Un sommeil insuffisant peut avoir des effets indésirables pour les deux, la mère et le fœtus. De même, les problèmes de sommeil ne sont pas rares pendant la ménopause. Le sommeil pendant la ménopause présente des caractéristiques telles que: l'insomnie et la fragmentation du sommeil[128]. HommeLes hommes sont plus susceptibles de souffrir d'apnée obstructive du sommeil et de mourir de ses conséquences. Les troubles du sommeil paradoxal sont plus souvent diagnostiqués chez les hommes. Ce trouble est souvent suivi d'un autre, à savoir un trouble neurodégénératif. Cette situation est plus souvent diagnostiquée chez les hommes âgés que chez les femmes âgées[128]. Disparité socialeDe nombreuses études ont documenté le fait que les minorités ethniques de la population, du point de vue du désavantage socio-économique, obtiennent une moins bonne qualité de sommeil. Aux États-Unis, les Afro-Américains sont plus susceptibles de moins bien dormir que les Blancs non hispaniques. Dans les enquêtes, les valeurs ont montré un résultat 2,5 fois plus élevé pour un sommeil très court, en dessous de 4 heures. En cas de sommeil court, entre 5 et 6 heures, cette valeur était deux fois plus élevée chez les Afro-Américains que chez les Blancs non hispaniques. La même tendance a été constatée pour les Asiatiques et les ethnies. Une étude de Philadelphie a constaté que la différence de qualité du sommeil entre les différentes ethnies dépendait en grande partie du facteur socio-économique. De même, plusieurs études ont constaté que la discrimination constituait un facteur de stress important qui influencerait considérablement la qualité du sommeil, car les personnes auraient des nuits plus courtes et rencontreraient des problèmes de sommeil[128]. Sommeil, un statut socialLes habitudes de sommeil peuvent être considérées comme un symbole de statut social. La personne que l'on tolère à proximité pendant le sommeil varie déjà fortement. Dans les classes sociales élevée et moyenne, il s'agit généralement d'un lieu de sommeil défini : "la chambre à coucher", qui est très privée. Souvent, seuls les proches sont admis dans la chambre à coucher. Les habitudes de sommeil d'un sans-abri s’opposent à cela. Celui-ci dort en public, à la vue de beaucoup de gens[127]. Gestion du sommeilHormis le facteur des différences entre les différentes couches sociales, le rapport au sommeil varie également. Ainsi, la situation mentale de départ est très individuelle et couvre un large spectre. Par exemple, un ouvrier qui exerce deux emplois pour nourrir sa famille considère le sommeil comme une nécessité. Alors qu'un étudiant a plus de temps, il se demande probablement comment il pourrait utiliser ce temps supposé être dédié au sommeil pour apprendre. Personne ne conteste que le sommeil soit essentiel à la survie, mais les approches de cet état non conscient sont très diverses. Et que ce soit consciemment ou inconsciemment, nous nous influençons nous-mêmes par le biais de notre attitude psychique vis-à-vis du sommeil. Cela écrit le sociologue Brian Taylor dans son article : « Unconsciousness and Society: The Sociology of Sleep ». Il n'est pas nécessaire de rester aussi général, car l'état psychique d'une personne change tout le temps. Ainsi, l'étudiant de l'exemple ci-dessus peut également percevoir le sommeil comme une nécessité pendant une phase d'apprentissage. L'attitude dépend donc de l'état psychique et des circonstances temporaires de la personne concernée[127]. Le sommeil dans la culture  Religions et mythologiesDans la religion grecque antique et la mythologie grecque, Hypnos est le dieu du sommeil. Le poète grec Hésiode le présente comme l'un des enfants de Nyx, la Nuit personnifiée ; il est le frère de Thanatos, le dieu du Trépas[129]. Un dieu distinct, Morphée, préside aux rêves. Le berger mythologique Endymion est voué à la fois à un sommeil éternel et à la jeunesse éternelle, qui lui ont été accordés à la demande de son amante, Séléné, déesse de la Lune. Chez les Romains, le dieu du Sommeil personnifié est Somnus. Dans la littératureDe nombreuses histoires évoquent des personnages qui dorment pendant une durée inhabituellement longue. Les auteurs grecs antiques évoquent la légende d'Épiménide qui aurait dormi pendant 57 ans dans une caverne et aurait acquis, à son réveil, un savoir rare ainsi que des dons de divination. Une légende du Moyen Âge, chrétienne et musulmane, celle des Sept Dormants d'Éphèse, adopte un thème proche, avec pour personnages un groupe de croyants victimes de persécution religieuse. En 1819, l'écrivain américain Washington Irving publie dans The Sketch Book of Geoffrey Crayon la nouvelle Rip Van Winkle, dont le héros éponyme s'endort pendant des dizaines d'années ; l'histoire devient un classique de la littérature américaine. Dans la pièce éponyme de Shakespeare, Macbeth exprime d'autant plus de remords à avoir assassiné Duncan, roi d'Écosse, qu'il lui a porté le coup fatal dans son sommeil, et après que Lady Macbeth a veillé à saouler les gardes du roi à l'aide de vin et de bière pour s'assurer qu'ils restent plongés dans un sommeil alcoolisé. Macbeth vit comme un sacrilège le fait d'avoir « tué le sommeil » avant de le décrire dans une tirade : « Le sommeil innocent, le sommeil qui démêle l'écheveau embrouillé du souci, le sommeil, mort de la vie de chaque jour, bain du labeur douloureux, baume des âmes blessées, second service de la grande nature, aliment suprême du banquet de la vie ! »[130] Dans les beaux-artsLe sommeil est un thème artistique classique dans la peinture et la sculpture. Voir la Catégorie:Sommeil dans la peinture et la Catégorie:Sommeil dans la sculpture. Notes et références
Voir aussiArticles connexes
Bibliographie
Radiographie
Liens externes
|
