|
Réaction de Corey-Fuchs
La réaction de Corey – Fuchs, également connue sous le nom de réaction de Ramirez – Corey – Fuchs, est une série de réactions chimiques conçues pour transformer un aldéhyde en alcyne. La formation des 1,1-dibromooléfines via les phosphine-dibromométhylènes a été découverte à l'origine par Desai, McKelvie et Ramirez. La deuxième étape de la réaction de conversion des dibromooléfines en alcynes est connue sous le nom de réarrangement de Fritsch – Buttenberg – Wiechell. La transformation combinée globale d'un aldéhyde en un alcyne par cette méthode porte le nom de ses développeurs, les chimistes américains Elias James Corey et Philip L. Fuchs .  En choisissant une base appropriée, il est souvent possible d'arrêter la réaction au niveau du 1-bromoalkyne, un groupe fonctionnel utile pour une transformation ultérieure. Mécanisme de réactionLa réaction de Corey – Fuchs est basée sur un cas particulier de la réaction de Wittig, où l'ylure de phosphore est formé de dibromocarbène. Ce carbène est généré in situ par la réaction de la triphénylphosphine avec du tétrabromure de carbone .  La triphénylphosphine attaque ensuite le carbène naissant pour former l'ylure réactif. Cet ylure subit une réaction de Wittig lorsqu'il est exposé à un aldéhyde.  Des études de marquage au deutérium montrent que la réaction se déroule via un mécanisme carbène. L'échange de lithium et de bromure est suivi d'une α-élimination pour donner le carbène. Le décalage 1,2 fournit alors l'alcyne terminale marquée au deutérium[1]. L'incorporation de 50% de H pourrait s'expliquer par la déprotonation du deutérium terminal (acide) avec un excès de BuLi. 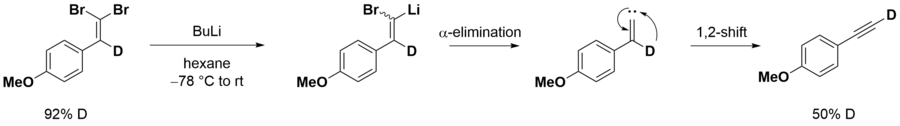 Voir également
Notes et références
Liens externes
|
