|
Réaction d'AsingerLa réaction d'Asinger ou synthèse de thiazoline d'Asinger est une réaction de chimie organique. Elle a été découverte par Friedrich Asinger (en) lors de son séjour forcé en Union soviétique (Action Ossoawiachim : déportation des scientifiques allemands en URSS)[1]. La réaction d'Asinger est l'une des réactions multi-composants classée comme A-4CR (abréviation de "Asinger-4 component reaction") : du soufre élémentaire, une cétone ou un aldéhyde α-substitué, un autre composant avec un groupe carbonyle et de l'ammoniac forment avec un bon rendement une 3-thiazoline[2] ou des mélanges de plusieurs 3-thiazolines :   MécanismeLe mécanisme expliqué sur une cétone est identique pour un aldéhyde (R3=H). Première étape : 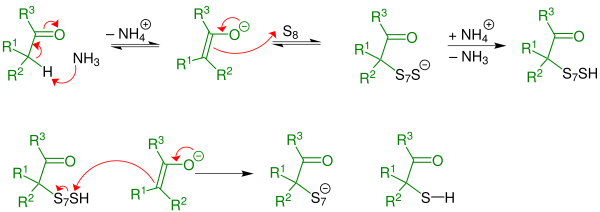 Une réaction de thiolation forme un intermédiaire α-mercaptocétone : L'α-thiolation est catalysée par une base - ici l'ammoniac- qui déprotone l'atome d'hydrogène en α de la cétone. La réaction est initiée par un énolate. Un cycle S8 du soufre élémentaire s'additionne sur la double liaison de l'énolate puis par protonation et réaction avec un autre énolate, forme une α-mercaptocétone et un polysulfure avec un soufre en moins qui par protonation et réaction avec d'autres énolates successivement forme de l'α-mercaptocétone jusqu'à ce qu'il soit lui-même une α-mercaptocétone. Deuxième étape :  L'α-mercaptocétone réagit de manière irréversible avec un aldéhyde et de l'ammoniac pour former une 3-thiazoline : L'aldéhyde est ici l'autre composé carbonyle dans la réaction de cyclisation. Il s'agit d'une α-amino-alkylation d'un atome du carbone lié à S et O et donc polarisé et, pour encore plus de stabilisation, d'une cyclisation concertée avec le départ d'une molécule d'eau. Finalement une seconde déshydratation transforme la 3-thiazolidine en 3-thiazoline. La formation de 3-thiazolines se produit également à l'aide d'α-thioaldéhyde ou d'α-thiocétone et d'ammoniac, ce qui revient à supprimer la première étape du mécanisme[3]. VarianteUne version plus simple de la réaction d'Asinger a été développée par la société Degussa AG. La réaction d'un composant carbonyle α-halogéné avec l'hydrogénosulfure de sodium, NaHS génère in situ le composant α-mercapto-carbonyle (α-thiol) qui peut réagir directement avec des aldéhydes ou des cétones et de l'ammoniac pour donner des 3-thiazolines[4] :  Dans l'industrie chimique, des procédés multi-composés basés sur cette variante de l'A-4CR (synthèse d'Asinger à 4 composants) ont été développés pour la production de produits pharmaceutiques tels que le médicament D-pénicillamine[5] et l'acide aminé DL-cystéine[6] :  La synthèse de 3-oxazolines (analogues oxygénés des 3-thiazolines) peut être réalisée via une autre variante de la réaction d'Asinger avec un 2-halogénoaldéhyde, de l'ammoniac, de l'hydroxyde de sodium, NaOH et un autre composé carbonyle, en général une cétone[7]. Notes et références
Bibliographie
|