|
MucormycoseMucormycose
ou zygomycose, phycomycose
 La mucormycose (ou zygomycose ou maladie du champignon noir ou mycose noire en raison des taches nécrosées qu'elle peut causer sur le visage) est une infection opportuniste et saisonnière, grave, de personnes immuno-déprimées, causée par un champignon, du phylum des Zygomycètes (plus large que le genre Mucor). Ces champignons, très courants dans les sols, décomposent la matière organique (fruits et légumes notamment) et le fumier animal, sans normalement infecter l'être humain[1]. Il n'y a pas de contagion inter-personnelle[2] ; la contamination se fait par inhalation, ingestion (aliments contaminés) ou via des plaies ouvertes[3]. Les symptômes varient selon les organes infectés[4],[2] (le plus souvent : le nez, les sinus, les yeux ou le cerveau, avec respectivement un écoulement nasal, un gonflement et une douleur du visage unilatéral, des maux de tête, de la fièvre, une vision floue, un œil enflé et bombé et une nécrose des tissus[5],[6]. D'autres formes de la maladie touchent les poumons, l'estomac, les intestins et la peau[6]. En 2020/2021, une forte hausse du taux de mucormycose a été observée en Inde chez des patients guéris de la Covid-19[7], probablement à la suite d'un abus d'utilisation de stéroïdes comme médicament contre la Covid-19 — avant cette pandémie, les cas de mucormycoses étaient rares et il s'agissait de patients atteints du diabète, infectés par le VIH ou ayant d'autres sources d'immunodépression (transplantations comprises)[8]. MécanismesLe champignon semble nécessiter la présence de fer pour se développer[9]. Le GRP78 est un récepteur sur l'endothélium des vaisseaux qui permet la fixation de champignons de l'ordre des Mucorales[10] par les protéines CotH de ceux-ci [11]. La maladieCette affection a été étudiée par Arnold Paltauf en 1885. Cette maladie est rare et grave (pouvant mettre en danger la vie du patient, avec un taux de mortalité d'environ 70 %[12]), due à une contamination par des Mucorales, champignons filamenteux couramment présents dans l'environnement, vivant dans le sol, sur les végétaux en décomposition ou les déjections animales. Ces mycoses touchent généralement le visage ou la cavité oropharyngée[13] et les poumons[14]. Les infections à Mucorales entraînent une destruction du tissu atteint, des infarctus locaux, des thromboses, favorisées par la sécrétion de toxines par le champignon[14]. La dissémination de l'infection est gravissime, avec une mortalité proche de 100 %[15], et a lieu en l'absence de prise en charge précoce de la maladie. Les pathogènes opportunistesLe plus souvent, les champignons responsables de la mucormycose chez l'homme sont de la classe des Zygomycètes et des genres Mucor et Rhizopus. Mais ils sont parfois aussi d'autres genres (Rhizor, Rhizomucor, Apophysomyces, Absidia, Mortierella, Cunninghamella, Saksenaea, Syncephalastrum, Cokeromyces...). L'essentiel des mucormycoses humaines sont dues à des zygomycètes type Mucorales, le plus souvent du genre Rhizopus[14],[16]. Comme ces champignons étaient autrefois classés parmi les Phycomycètes, on parle aussi de « phycomycose ». ÉpidémiologieC'est la troisième mycose invasive par ordre d'importance, après les candidoses et les aspergilloses[17], mais elle est rare et même exceptionnelle chez le sujet non-immunodéprimé[14] (ex. : moins de deux cas par million de personnes et par an à San Francisco)[18]. GénéralitésL'infection apparaît souvent après une infection initiale des fosses nasales par un champignon, lequel colonise ensuite d'autres parties de l'organisme. Les facteurs de risque comprennent le diabète (cas les moins rares)[19] associés à une glycémie élevée persistante ou une acidocétose diabétique, un faible nombre de globules blancs, le cancer, une greffe d'organe, une surcharge en fer, des problèmes rénaux, l'utilisation à long terme de stéroïdes ou d'immunosuppresseurs et, dans une moindre mesure, le VIH/SIDA[20],[21]. Les formes rhinocérébrales prédominent chez le diabétique[15], en raison de complications telle que l'acidocétose (l'infection étant probablement favorisée par la libération des ions fer par la transferrine en cas d'acidocétose[22]). Sinon les patients sont des malades en état de déficit immunitaire[19] (immunodépression induites par le SIDA ou à la suite d'une corticothérapie longue, après transplantation d’organe, hémopathie maligne, traitement par déféroxamine). IndeDans les années 2010-2020, l'Inde est le pays le plus touché au monde par la mucormycose, à cause de la conjonction de deux facteurs : le climat chaud et humide favorise grandement le développement du champignon, et l'Inde était dans les années 2010 l'un des pays les plus touchés au monde par le diabète (74 millions de diabétiques en Inde en 2017)[23]. Au printemps 2021, l'épidémie de Covid-19 en Inde, qui est alors la plus violente au monde à ce moment de la pandémie, rajoute un facteur d'infection supplémentaire[23] . Les chiffres exacts de l'épidémie de mucormycose en 2021 étaient dans un premier temps inconnus du grand public, le gouvernement indien avait refusé de communiquer les données nationales sur le sujet (l'Hôpital Sion de Bombay précise toutefois avoir enregistré 24 cas de mucormycose en mars et dont 6 se sont soldés par la mort d'un patient et 11 par la perte d'un œil)[23]. Fin mai, les autorités indiennes déclaraient plus de 12 000 cas de mucormycose[24]. Lien entre les infections virales, traitements aux corticoïdes et mucormycoseAu printemps 2021, une épidémie de mucormycose est observée en Inde chez des patients diabétiques, tous récemment atteints par la Covid-19, au moment de la pandémie où l'Inde était atteinte par une vague très violente et était devenue le principal foyer épidémique mondial[23]. Ceci met en lumière un lien déjà soupçonné entre les infections virales et l'infection par le champignon noir[23]. Les infections virales de manière générale favorisent l'apparition de maladies fongiques[23]. En-dehors des zones de répartition du mucormycose, des cas d'aspergillose pulmonaire (une autre infection fongique moins dangereuse) ont été relevés chez des patients atteints du Covid-19[23]. Cependant, dans le cas particulier de cette maladie, il semblerait toutefois que ce soit la conjonction d'un diabète de type 2[25] et d'un traitement à base de corticoïdes affaiblissant le système immunitaire qui favorise l'infection mucorale et non le virus SARS-CoV-2 lui-même[23]. DiagnosticLe diagnostic repose sur la biopsie et la mise en culture, ainsi que sur l'imagerie médicale[26] pour la différencier de l'aspergillose. L'amphotéricine B et le débridement chirurgical sont les principaux traitements. La prévention passe par le port d'un masque facial dans les zones poussiéreuses, l'évitement du contact avec les bâtiments endommagés par l'eau et la protection de la peau contre l'exposition au sol, comme lors du jardinage ou de certains travaux extérieurs[27]. L'infection progresse rapidement et est mortelle dans environ la moitié des cas de sinus infecté et dans presque tous les cas de type répandu[28]. Diagnostic différentielIl faut au moins aussi envisager[13] :
Culture et biopsiesPour confirmer le diagnostic, des échantillons issus de biopsie peuvent être mis en culture[4],[29], sans toujours donner de bons résultats car cet organisme est très fragile[30]. L'identification précise de l'espèce fongique en cause (genre, espèce) ne peut être faite que par un expert[30], sur la base de la morphologie du champignon observée sous microscope[29]. L'apparence peut varier mais l'histopathologie montre généralement de larges filaments en forme de ruban, généralement dépourvus de septa et qui, contrairement à l'aspergillose, se ramifient à angle droits, donnant des formes évoquant les bois d'un orignal, quand il est observé en train d'envahir les vaisseaux sanguins[31].
TraitementLa prise en charge doit être la plus rapide possible afin d'éviter l'extension et la dissémination. Le débridement chirurgical large doit être préféré, possible ou non selon la localisation de l'infection fongique. Le traitement fongique est à base d'amphotéricine B en première intention. La posaconazole a une certaine efficacité[33]. Les traitements visant à une chélation du fer pourraient avoir un intérêt[34]. Notes et références
Voir aussiArticles connexesLien externe |

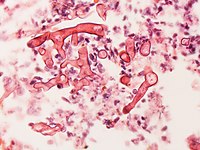

![Sporange mature de Mucor[32].](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c5/Mature_sporangium_of_a_Mucor_sp._fungus.jpg/200px-Mature_sporangium_of_a_Mucor_sp._fungus.jpg)