|
Síntesis de indol de FischerLa síntesis de indol de Fischer es una reacción química que produce el compuesto heterocíclico aromático indol a partir de una fenilhidrazina (sustituida) y un aldehído o cetona en condiciones ácidas.[1][2] La reacción fue descubierta en 1883 por Hermann Emil Fischer. Hoy medicamentos antimigraña de la clase triptán a menudo se sintetizan mediante este método.  La elección del catalizador ácido es muy importante. Ácidos de Brønsted como HCl, H2SO4, ácido polifosfórico y ácido p-toluenosulfónico han sido utilizados con éxito. Ácidos de Lewis como trifluoruro de boro, cloruro de zinc, cloruro de hierro y cloruro de aluminio también son catalizadores útiles para esta reacción. Varias revisiones han sido publicadas.[3][4][5] Mecanismo de reacciónLa reacción de una fenilhidrazina (sustituida) con un carbonilo (aldehído o cetona) forma inicialmente una fenilhidrazona que isomeriza a la enamina respectiva (o 'eno-hidrazina'). Después de la protonación, se produce una transposición sigmatrópica produciendo una imina. La imina resultante forma un aminoacetal cíclico (o aminal), que bajo el catálisis ácido elimina NH3, dando como resultado la indol aromático energéticamente favorable. 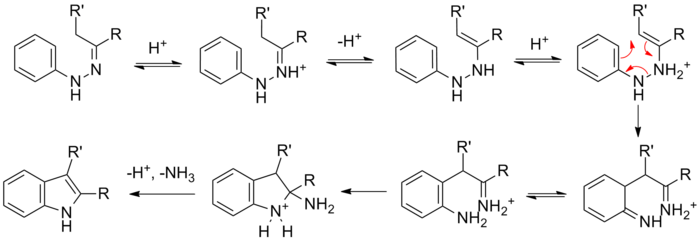 Los estudios de marcaje isotópico muestran que el nitrógeno del arilo (N1) de la fenilhidrazina de partida se incorpora al indol resultante.[6][7] Modificación de BuchwaldA través de una reacción catalizada por paladio, la síntesis de indol de Fischer puede efectuarse mediante el acoplamiento cruzado de bromuros de arilo e hidrazonahidrazonas.[8] Este resultado apoya la intermediación previamente propuesta como intermedios de hidrazona en la síntesis de indol de Fischer clásica. Estas N - arilhidrazonas se intercambian con otras cetonas, lo que amplía el alcance de este método.  Ácido metanosulfónico puede usarse como catalizador ácido en esta reacción. Aplicación
Véase también
Referencias
|