|
1,2-hexanodiol |
|---|
 |
 | | Nombre IUPAC |
|---|
|
Hexano-1,2-diol | | General |
|---|
| Otros nombres |
1,2-dihidroxihexano |
|---|
| Fórmula semidesarrollada |
CH3-(CH2)3-CHOH-CH2OH |
|---|
| Fórmula molecular |
C6H14O2 |
|---|
| Identificadores |
|---|
| Número CAS |
6920-22-5[1] |
|---|
| ChemSpider |
85137 |
|---|
| DrugBank |
DB14108 |
|---|
| PubChem |
94335 |
|---|
| UNII |
TR046Y3K1G |
|---|
|
| |
| | Propiedades físicas |
|---|
| Apariencia |
Líquido incoloro o de color amarillo pálido |
|---|
| Olor |
Palomitas de maíz |
|---|
| Densidad |
915 kg/m³; 0,915 g/cm³ |
|---|
| Masa molar |
11 817 g/mol |
|---|
| Punto de fusión |
−25 °C (248 K) |
|---|
| Punto de ebullición |
223 °C (496 K) |
|---|
| Presión de vapor |
9 mbar (105 °C) |
|---|
| Índice de refracción (nD) |
1,442 |
|---|
| Propiedades químicas |
|---|
| Solubilidad en agua |
2,7 × 104 g/L |
|---|
| log P |
0,25 |
|---|
| Familia |
Alcohol |
|---|
| Peligrosidad |
|---|
| Punto de inflamabilidad |
395,25 K (122 °C) |
|---|
| NFPA 704 |
|
|---|
| Temperatura de autoignición |
663,25 K (390 °C) |
|---|
| Riesgos |
|---|
| LD50 |
> 5 g/kg |
|---|
| Compuestos relacionados |
|---|
| alcoholes |
1-hexanol
2-hexanol |
|---|
| dioles |
1,2-pentanodiol
1,2-heptanodiol |
|---|
| polioles |
Trimetilolpropano
1,2,6-hexanotriol |
|---|
Valores en el SI y en condiciones estándar
(25 ℃ y 1 atm), salvo que se indique lo contrario. | |
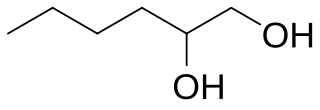
El 1,2-hexanodiol o hexano-1,2-diol es un alcohol de fórmula molecular C6H14O2. Es isómero de posición del 1,6-hexanodiol y del pinacol, siendo un diol vecinal cuyos dos grupos funcionales hidroxilo se encuentran en las posiciones 1 y 2 de una cadena lineal de seis átomos de carbono. Es una molécula quiral dado que el átomo de carbono de la posición 2 es asimétrico.
Propiedades físicas y químicas
El 1,2-hexanodiol es un líquido incoloro o de color amarillo pálido con olor a palomitas de maíz. Con una densidad de 0,915 g/cm³, su punto de congelación es -25 °C y su punto de ebullición 223 °C.[2][3]
En fase gaseosa, su densidad es 4,1 veces mayor que la del aire.
El valor estimado del logaritmo de su coeficiente de reparto (logP) entre 0,25 y 0,7, indica una mayor solubilidad en disolventes hidrófobos —como el 1-octanol— que en disolventes hidrófilos.[4][5]
En disolución acuosa, presenta comportamiento micelar a concentraciones por encima de la concentración micelar crítica (CMC).[6]
Síntesis y usos
El 1,2-hexanodiol puede sintetizarse por reducción de 2-hidroxicaproato de etilo con trimetoxisilano, proceso catalizado por metóxido de litio,[7] siendo el rendimiento del 99%:[8]

También la reducción del 2,3-epoxihexan-1-ol, en este caso utilizando como agente Bu3SnH/Bu3Snl-óxido de fosfina, produce 1,2-hexanodiol.[9]
Análogamente se puede usar como precursor 1,2-epoxihexano: en agua tiene lugar la apertura del anillo, generándose 1,2-hexanodiol, en una reacción catalizada por triflato de erbio(III).[10]
Este diol también se puede obtener partiendo del 4-butil-2,2-dimetil-1,3-dioxolano, en una reacción de escisión en acetonitrilo acuoso empleando acetales de dicianocetona (DCKA) como catalizadores.[11]
Una distinta ruta de síntesis implica la dihidroxilación de 1-hexeno con tetraóxido de osmio fluoroso (FOsO4) como catalizador reutilizable.[12]
Los 1,2-dioles son conocidos agentes antimicrobianos.[13]
En este contexto se ha estudiado el 1,2-hexanodiol, combinado con el 1,4-ciclohexanodiol, en la adsorción percutánea del fármaco metronidazol, antibiótico y antiparasitario;[14] este diol retarda la adsorción de este fármaco, minimizando la toxicidad sistemática potencial mientras se mantiene la eficacia terapéutica.[15]
Otro uso del 1,2-hexanodiol es como disolvente en cosméticos, formando parte de productos para el cuidado del cabello, cremas, lociones y geles,[16] reemplazando a los parabenos. Puede tener aplicación como humectante,[17] como desodorante para evitar el mal olor corporal[18] o por sus propiedades antibacterianas.[19]
Asimismo, se han investigado diversos 1,2-alcanodioles en cuanto a su potencial para irritar la piel: el 1,2-hexanodiol es el que produce una menor irritación, aumentando esta conforme la longitud de la cadena carbonada aumenta o disminuye de tamaño en relación con la de este diol.[20]
Precauciones
El punto de inflamabilidad del 1,2-hexanodiol es 122 °C, siendo su temperatura de autoignición 390 °C.
Es nocivo por inhalación y puede provocar irritación severa en los ojos.[2][21]
Véase también
Los siguientes compuestos son isómeros del 1,2-hexanodiol:
Referencias
- ↑ Número CAS
- ↑ a b DL-1,2-Hexanediol. Safety data sheet (ThermoFisher)
- ↑ DL-1,2-Hexanediol (Chemical Book)
- ↑ TR046Y3K1G (ChemSpider)
- ↑ 1,2-Hexanediol (PubChem)
- ↑ Hajji, M.S. (2003). «Heat capacity studies of formation of micelle-like structure in aqueous solutions of some alkane polyols». Journal of Colloid and Interface Science 257 (2): 364-370. Consultado el 29 de septiembre de 2018.
- ↑ Hojo, M.; Murakami, C.; Fujii, A.; Hosomi, A. (1999). «New reactivity of methoxyhydridosilane in the catalytic activation system». Tetrahedron Letters 40 (5): 911-914. Consultado el 24 de septiembre de 2018.
- ↑ Synthesis Route for 6920-22-5 (Molbase)
- ↑ Kawakami, T.; Tanizawa, D.; Shibata, I.; Baba, A. (1995). «Chemo- and regioselective reductions of functionalized epoxides by Bu3SnH/Bu3SnI-phosphine oxide». Tetrahedron Letters 36 (51): 9357-9360. Consultado el 24 de septiembre de 2018.
- ↑ Dalpozzo, R.; Nardi, M.; Oliverio, M.; Paonessa, R.; Procopio, A. (2009). «Erbium(III) Triflate is a Highly Efficient Catalyst for the Synthesis of β-Alkoxy Alcohols, 1,2-Diols and β-Hydroxy Sulfides by Ring Opening of Epoxides». Synthesis 20: 3433-3438. Consultado el 24 de septiembre de 2018.
- ↑ Masaki, Y.; Yamada, T.; Tanaka, N. (2001). «Novel Polymer Effect in Cleavage Reactions of Acetals and Silyl Ethers in Aqueous Media Catalyzed by a Polymer-Supported Dicyanoketene Acetal». Synlett 8: 1311-1313. Consultado el 26 de septiembre de 2018.
- ↑ Huang, Y.; Meng, W.-D.; Qing, F.-L. (2003). «Fluorous osmium tetraoxide (FOsO4): a recoverable and reusable catalyst for dihydroxylation of olefins». Tetrahedron Letters 45 (9): 1965-1968. Consultado el 25 de septiembre de 2018.
- ↑ Akedo, M.; Sinskey, A.J.; Gomez, R. (1977). «Antimicrobial action of aliphatic diols and their esthers». Journal of Food Science 42: 699-671. Consultado el 24 de septiembre de 2018.
- ↑ Li, N.; Jia, W.; Zhang, Y.; Tan, F.; Zhang, J. (2011). «Synergistic effect of 1,4-cyclohexanediol and 1,2-hexanediol on percutaneous absorption and penetration of metronidazole». Int J Pharm. 415 (1-2): 169-174. Consultado el 24 de septiembre de 2018.
- ↑ Li, N.; Jia, W.; Zhang, Y.;, Zhang, M.C.; Tan, F.; Zhang, J. (2014). «Effect of Hydrocarbon Chain Length in 1,2-Alkanediols on Percutaneous Absorption of Metronidazole: Toward Development of a General Vehicle for Controlled Release». AAPS PharmSciTech 15 (2): 354-363. Consultado el 29 de septiembre de 2018.
- ↑ 1,2-hexanediol (SpecialChem)
- ↑ Method for skin-whitening using composition containing resveratryl triglycolate. Boo, Yong Chool; et al. (2017) Patente US2017210694
- ↑ Cosmetic composition, useful as a deodorant, comprises 1,2-hexanediol, 1,2-octanediol, triethyl citrate, a cationic phospholipid compound and carrier containing water, ethanol, oil and/or talc, and optionally other excipients and adjuvants. Banowski, B.; Breuer, I. (2011) Patente DE102011084155A1
- ↑ «External preparation for skin. Tada, et al. (2010) Patente US7795300». Archivado desde el original el 29 de septiembre de 2018. Consultado el 29 de septiembre de 2018.
- ↑ Lee, E.; An, S.; Cho, S.A.; Yun, Y.; Han, J.; Hwang, Y.K.; Kim, H.K.; Lee, T.R. (2011). «The influence of alkane chain length on the skin irritation potential of 1,2-alkanediols». Int J Cosmet Sci. 33 (5): 421-425. Consultado el 24 de septiembre de 2018.
- ↑ «1,2-Hexanediol. Safety sheet (Elan Chemical)». Archivado desde el original el 21 de agosto de 2018. Consultado el 25 de septiembre de 2018.
|



