|
Staphyloxanthin
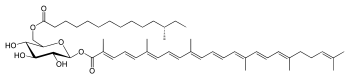
 Staphyloxanthin ist ein orange- oder goldgelber Farbstoff in der Zellmembran des Bakteriums Staphylococcus aureus. Das Pigment gehört zu den Xanthophyllen (sauerstoffhaltige Carotinoide). Das Carotinoidpigment wirkt als biologisches Antioxidans, indem es die von den Immunzellen des Wirts gebildeten reaktiven Sauerstoffverbindungen inaktiviert und dadurch die Mikroorganismen vor dem Abtöten durch die weißen Blutzellen schützt.[3] Gerade bei den antibiotikaresistenten Superkeimen, den MRSA-Vertretern, deren Verbreitung in der Bevölkerung und in den Krankenhäusern seit 1990 rasant zugenommen hat, bildet Staphyloxanthin einen bedeutenden Virulenzfaktor. Zugleich schützt der Farbstoff die MRSA-Keime vor der Zerstörung durch Wasserstoffperoxid und Sauerstoffradikale.[4] VorkommenStaphyloxanthin wird in der Zellmembran des Bakteriums Staphylococcus aureus eingebaut und ist für dessen Färbung verantwortlich. Das Pigment ist gelb oder orange, in Abhängigkeit vom Sauerstoffangebot und den Nährstoffbedingungen. Die Farbe ist namensgebend für die Spezies (aureus, lateinisch für ‚golden‘). Neben dem Hauptpigment lassen sich verschiedenfarbige Zwischenprodukte des Biosynthesewegs isolieren.[5][6] Aufbau und FunktionStrukturaufklärungDer Pigmentname, Staphyloxanthin, wurde erstmals[7] 1972 von John H. Marshall und E. S. Rodwell erwähnt.[8] 1981 isolierten und analysierten Marshall und Willmoth die chemischen Strukturen des Farbstoffs und weiterer Biosyntheseprodukte.[9] Das Hauptpigment wurde zunächst als ein α-D-Glucopyranosyl-1-O-(4,4ʹ-diaponeurosporen-4-oat)-6-O-(12-methyltetradecanoat) identifiziert, in dem Glucose mit einer Triterpenoid-Carotinoid-Carbonsäure und einer Fettsäure (C15) verestert ist. 2005 konnte mittels NMR-Spektroskopie die Struktur als eine β-D-Glucopyranosyl-1-O-(4,4ʹ-diaponeurosporen-4-oat)-6-O-(12-methyltetradecanoat)-Verbindung ermittelt werden. Von den in photosynthetisch und nicht photosynthetisch aktiven Bakterien und in Eukaryoten vorkommenden Carotinoiden mit 40 C-Atomen (C40), unterscheidet sich Staphyloxanthin durch die Veresterung von Glucose mit einer Triterpenoidsäure (C30) und einer Fettsäure (C15) sowie den Hydroxygruppen der Glucose.[1] Der Bakterienfarbstoff ist ein Vertreter der Triterpene, die zu den sekundären Inhaltsstoffen von Organismen gehören. Sie leiten sich formal vom Isopren ab. Staphyloxanthin ist ein fettlöslicher Farbstoff mit langkettigen Kohlenwasserstoffen, der zu den Carotinoiden gehört. Carotinoide kommen allgemein in vielen photosynthetischen und nicht photosynthetischen Organismen vor und haben in Bakterien und Hefen antioxidative Funktionen. Sie spielen eine Rolle bei der Lichtgewinnung, dem Energietransfer und der Regulierung der Membranfluidität.[10][11] Physiologische BedeutungDurch zahlreiche konjugierte Doppelbindungen vermag Staphyloxanthin freie Energie von reaktiven Sauerstoffverbindungen zu absorbieren und unschädlich zu machen.[12][13][14] Als Radikalfänger kann das Carotinoid Singulettsauerstoff löschen und die Mikroben vor aggressiven Wasserstoffperoxid und Hydroxyl-Radikalen schützen. Diese Verbindungen sind vor allem bei der Immunreaktion im menschlichen Körper von Bedeutung. Hier werden in Phagosomen der Neutrophilen durch die NADPH-Oxidase reaktive Sauerstoffspezies zur Entfernung von Erregern gebildet. Staphylococcus-aureus-Bakterien können diesen mit Hilfe der antioxidativen Wirkung von Staphyloxanthin überleben.[15][16] Als Membrancarotinoid beeinflusst der Farbstoff die Fluidität der Zellmembran und damit die Membranfestigkeit. Dies hat Auswirkungen auf die chemischen Eigenschaften und die funktionelle Aktivität der bakteriellen Zellmembran. Mit Staphyloxanthin pigmentierte Staphylokokken-Bakterien haben daher eine höhere Resistenz, da sie eine bessere Überlebenschance gegen antimikrobielle, von Zellen des Wirts gebildete Peptide und Proteasen haben. Damit weisen farbige Staphylokokken gegenüber weißen Vertretern eine höhere Vitalität auf. Zusätzlich schützt der Farbstoff die Mikroben vor der photooxidativen Zerstörung.[17][16] Staphyloxanthin ähnelt somit in seiner physiologischen Bedeutung den Glycolipiden, obgleich es nicht zu diesen gezählt werden kann, weil die Säuren nicht glykosidisch an den Zucker gebunden sind. Chemisch-physikalische EigenschaftenStaphyloxanthin löst sich auf Grund seiner Moleküleigenschaften schlecht in polaren Lösungsmitteln, hingegen gut in Chloroform und Chloroform-Methanol-Gemischen. Gereinigtes Staphyloxanthin löst sich sehr gut in Petrolether. Isoliertes Staphyloxanthin weist ein Absorptionsmaximum im sichtbaren Licht bei einer Wellenlänge von λ=460 nm im Lösungsmittel Methanol oder Aceton auf und ein Absorptionsmaximum von λ=462 nm mit einem kleinen Seitenpeak bei λ=491 nm in Petrolether auf.[18] HPLC-UV-Analysen von aufgereinigtem Staphyloxanthin zeigten unter Verwendung eines linearen Aceton/Wassergradienten ein Absorptionsspektrum mit Peaks bei 463 nm und einem Seitenpeak bei 490 nm.[1] BiosyntheseDie fünf Strukturgene zur Synthese von Staphyloxanthin liegen in dem Operon crtOPQMN (CrtO, CrtP, CrtQ, CrtM und CrtN).[1] Das AldH-Gen in Staphylococcus aureus, das sich 670 Kilobasenpaare jenseits des Operons befindet, kodiert für eine 4,4′-Diaponeurosporen-Aldehyd-Dehydrogenase (AldH). Dieses Enzym ist vermutlich für die vollständige Synthese des Farbstoffs von Bedeutung. Fehlt dieses Gen, akkumuliert 4,4′-Diaponeurosporen-4-al und wird nicht in Staphyloxanthin überführt.[19] SynthesewegDie Synthese der Triterpene beginnt mit der Kondensation von zwei Molekülen Farnesylpyrophosphat (FPP) C15H25O7P23− zu 4,4′-Diapophytoen (Dehydrosqualen) C30H48, katalysiert durch die Dehydrosqualensynthetase (CrtM).[20] Aus der folgenden Oxidation durch die Dehydrosqualen-Desaturase CrtN geht das gelbe Zwischenprodukt 4,4-Diaponeurosporen C30H42 hervor. 4,4-Diaponeurosporen zeigt in einem Petroleum-Acetongemisch ein Absorptionsspektrum mit drei Peaks bei den Wellenlängen von 412 nm, 435 nm und 465 nm.[18] 4,4-Diaponeurosporen C30H42 wird zur Säure 4,4-Diaponeurosporensäure C30H40O2 oxidiert (Gen CrtP).[1] Die Glycosyltransferase CrtQ verestert die Hydroxygruppe der Glucose am ersten C-Atom mit der 4,4-Diaponeurosporensäure. Im letzten Biosyntheseschritt findet die Verknüpfung der 12-Methyltetradecansäure, einer C15-Fettsäure, mit der Hydroxygruppe am sechsten C-Atom der Glucose zu dem goldgelben Pigment Staphyloxanthin statt.[19] RegulationDie Staphyloxanthin-Biosynthese ist sehr komplex und kann auf verschiedenen Stoffwechselebenen reguliert werden. Das Operon, in dem die Gene der Biosynthese organisiert sind, wird von einem Sigma-Faktor (B)-abhängigen Promotor reguliert und durch eine Terminator-Sequenz beendet. Der alternative Sigma-Faktor B, der an eine bestimmte DNA-Sequenz im crt-Promotorbereich des Operons bindet, reguliert direkt die Synthese von Staphyloxanthin.[21] Deletions-Mutanten, die keinen Sigma-Faktor besitzen, waren weiß und zeigten keine Pigmentbildung.[22] Darüber hinaus beeinflusst das vom Sigma-Faktor abhängige Kälteschockprotein A (CspA) als positiver Regulator das Operon und die Synthese der Stoffwechselprodukte.[23] Zusätzlich zu diesen Mechanismen wirken weitere Signaltransduktions-Systeme auf den Staphylokokken-Metabolismus und auf die Staphyloxanthin-Synthese.[24][25] Staphyloxanthin als mögliches Target in der antimikrobiellen Therapie Staphylococcus aureus gehört zur normalen Besiedlungsflora des Menschen und besiedelt vor allem die Haut und die Schleimhäute. Erst bei einer Immunschwäche, bedingt durch Grunderkrankungen des Menschen, treten – teilweise schwerwiegende – Staphylococcus-aureus-Infektionen auf, wie beispielsweise Mastitis, postoperative Wundinfektionen und Furunkeln. Neben dem Staphyloxanthin, dem Hauptpathogenitätsfaktor, bildet dieser Keim eine Vielzahl weiterer extrazellulärer Virulenzfaktoren wie Hämolysine, Koagulase, Toxisches Schocksyndrom und Protein A. Gefürchtet werden auch die durch Staphylokokken hervorgerufenen Lebensmittelvergiftungen durch Enterotoxine.[21][26] Bis in die 1990er Jahre traten gegen das Antibiotikum Methicillin resistente Staphylokokken (MRSA) ausschließlich in Krankenhäusern auf. Danach nahm die Verbreitung antibiotikaresistenter Infektionen auch außerhalb von Krankenhäusern zu, seit 2005 werden MRSA-Infektionen auch bei Nutztieren beobachtet.[27] Aufgrund auftretender Multidrug-Resistenzstämme, sogenannter Superkeime, sind diese MRSA-Erreger auch gegen alle anderen β-Lactam-Antibiotika resistent, die ursprünglich zur Behandlung von Staphylococcus-aureus-Infektionen eingesetzt worden waren. Die medizinische Behandlung von Infektionen durch solche Mikroben, die sich als Vertreter der Linezolid-resistenten MRSA (LRSA) und der Vancomycin-intermediären und -resistenten MRSA (VISA und VRSA) erweisen, erfordert eine rasche Entwicklung neuer Antiinfektiva.[28][29] Behandlung mit Rhodomyrtus-Extrakt Rhodomyrtus tomentosa (Aiton) Hassk. ist eine immergrüne Strauchpflanze der Gattung Rhodomyrtus, die zur Familie der Myrtengewächse gehört. Die Pflanze kommt im Süden und Südosten Asiens vor und wurde in der traditionellen chinesischen und malaysischen Medizin zur Behandlung verschiedener bakterieller Entzündungen verwendet. In mehreren Studien konnte 2019 von den Wissenschaftlern Thanh Sang Vo und Dai Hung Ngo die Wirkung der biologisch aktiven Metabolite von Rhodomyrtus auf verschiedene Mikroorganismen gezeigt werden.[30] In Staphylococcus aureus hemmte ein Extrakt aus Rhodomyrtus tomentosa die Staphyloxanthin-Biosynthese und setzte die Resistenz gegenüber Wasserstoffperoxid und Singulettsauerstoff herab.[31] Darüber hinaus konnten Störungen der bakteriellen Zellwand-Biosynthese und der Zellteilung sowie Hemmungen verschiedener Enzyme von wichtigen Stoffwechselwegen von Staphylococcus aureus nachgewiesen werden, was die Vitalität dieser Bakterien gegenüber solchen ohne Behandlung mit dem Extrakt minderte.[32] Den Wirkstoffen aus Rhodomyrtus kann nach den Studien eine die bakterielle Zellmembran schädigende Wirkung zugesprochen werden sowie eine Veränderung der Fluidität der Zellmembran.[33][30] Bestrahlung mit blauem LichtIn einer Studie im Jahr 2019 konnten Pu-Ting Dong u. a. an Biofilmen von Staphylococcus aureus und an Wundinfektionen bei Mausmodellen zeigen, dass Staphyloxanthin durch die Bestrahlung mit blauem Licht photochemisch zersetzt wurde und damit seine antioxidative Wirkung verlor. Die orange pigmentierten MRSA-Keime zeigten nach Bestrahlung im sichtbaren Lichtwellenlängenbereich von λ=460 nm eine veränderte Membranpermeabilität. Diese führte zu einer erhöhten Empfindlichkeit der Mikroben gegenüber Wasserstoffperoxid und anderen reaktiven Sauerstoffverbindungen. Die synergistische Wirkung von Photobleichung und schwachen Desinfektionsmitteln könnte für eine neue therapeutische Behandlungsmethode zur Bekämpfung von MRSA-Infektionen vielversprechend eingesetzt werden.[3] Weblinks
Einzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||