|
Ischämischer Schlaganfall
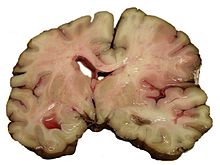  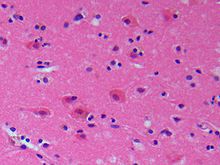 Der ischämische Schlaganfall oder Hirninfarkt (veraltet „weißer Schlaganfall“) ist eine neurologische Erkrankung durch plötzliche Minderdurchblutung und daraus folgender Minderversorgung des Gehirngewebes. Die Minderdurchblutung wird meist durch Einengung oder Verschluss einer oder mehrerer hirnversorgender Arterien verursacht. Selten sind Venenverschlüsse die Ursache. Der ischämische Schlaganfall ist die häufigste Form des Schlaganfalls. Die Symptome sind abhängig von der betroffenen Region im Gehirn. Der ischämische Schlaganfall kann mit reversibler Symptomatik oder mit dauerhaften Folgen für die Gesundheit sein. Der ischämische Schlaganfall ist immer ein medizinischer Notfall, auch bei leichter oder vorübergehender Symptomatik. Seine Therapie hat in der Regel nur in einem engen zeitlichen Fenster von wenigen Stunden Aussicht auf Erfolg und wird vorzugsweise in spezialisierten neurologischen Abteilungen, sogenannten Stroke Units, durchgeführt. In der Nachsorge kommen Ergotherapie, Physiotherapie, Logopädie und in gewissen Fällen auch Psychotherapie zum Einsatz. Der ischämische Schlaganfall gehört in den Industriestaaten zu den führenden Invaliditäts- und Todesursachen. In Deutschland ist er die dritthäufigste Todesursache. Vorkommen und HäufigkeitDer Schlaganfall ist in Deutschland nach Herzinfarkt und bösartigen Neubildungen (Krebs) mit 15 Prozent aller Todesfälle die dritthäufigste Todesursache. Unter den Schlaganfällen bilden die ischämischen Schlaganfälle mit etwa 80 Prozent die größte Gruppe.[1] Zudem stellt der Schlaganfall die häufigste Ursache für erworbene Behinderungen im Erwachsenenalter dar. Untersuchungen zur Epidemiologie des Schlaganfalls geben für Deutschland eine Inzidenz von 182/100.000.[2] Absolut sind dies 150.000 neu aufgetretene Schlaganfälle und rund 15.000 Rezidivfälle pro Jahr. Die Prävalenz liegt bei etwa 600/100.000 Einwohnern pro Jahr. Der Schlaganfall ist auch die häufigste Ursache für eine Pflegebedürftigkeit im Alter. UrsachenMakroangiopathieAls Makroangiopathie werden allgemein Veränderungen großer Gefäße bezeichnet. Eine häufige Ursache ischämischer Schlaganfälle ist die Makroangiopathie der großen hirnversorgenden Arterien, die meist durch atherosklerotische Plaques verursacht wird. Durch verschiedene Mechanismen wie Blutdruckanstieg und Infektionen kann es zu einem Aufreißen (einer Ruptur) der Plaques kommen, und es können sich Blutgerinnsel auflagern. Diese lokalen arteriellen Thrombosen können einerseits zu einer Verengung des Gefäßes führen, so dass der zerebrale Blutfluss hinter der Engstelle vermindert ist und eventuell unzureichend für die Versorgung des Hirngewebes ist (siehe den Abschnitt Thrombosen). Andererseits können die lokalen Thromben mit dem Blutstrom mitgerissen werden und damit eine Embolie auslösen. Der Embolus kann dann ein weiter entferntes Blutgefäß verschließen (siehe den Abschnitt Embolien).[3] TOAST-Klassifikation Gängig, aber umstritten ist die Differenzierung nach TOAST (Lit.: Adams 1993), Zahlen für Deutschland:
KrankheitsentstehungUnterbrechung der SubstratzufuhrDas Gehirngewebe wird wie andere Gewebe über das Blut mit Energiesubstraten und Sauerstoff versorgt. Das Gehirn bezieht die Energie hauptsächlich aus dem Abbau von Glukose. Dabei werden über 95 Prozent der Glukose über Glykolyse und die Atmungskette abgebaut, wofür Sauerstoff benötigt wird (aerober Stoffwechsel). Bei Sauerstoffmangel wird die Glukose zu größeren Anteilen über den anaeroben Stoffwechselweg (Glykolyse und Milchsäuregärung) abgebaut. Beim anaeroben Stoffwechselweg ist die Energieausbeute wesentlich geringer. Daher und aufgrund nur geringer Glukose- und Sauerstoffvorräte kann eine Unterbrechung der Substratzufuhr nur kurzzeitig toleriert werden. Bei kompletter Unterbrechung der Sauerstoffzufuhr ist der Sauerstoff in der zellreichen grauen Substanz bereits nach 68 Sekunden verbraucht, die Glukose nach 34 Minuten. Nach 4 bis 5 Minuten sterben erste Nervenzellen („es treten Nekrosen auf“).[4] Zerebraler Blutfluss, Ischämie- und InfarktschwelleEin Maß für die Hirndurchblutung ist der zerebrale Blutfluss (engl. cerebral blood flow, CBF). Neben dem zerebralen Blutfluss sind der Glukose- und der Sauerstoffanteil im Blut wichtige Parameter. Der zerebrale Blutfluss ist abhängig von Herzleistung und Blutdruck, dem peripheren Gefäßwiderstand und dem Druck in der Schädelhöhle (intrakranieller Druck). Wie andere Körperzellen besitzen Hirnzellen einen Strukturstoffwechsel zur Aufrechterhaltung der Zellstruktur und einen Funktionsstoffwechsel zur Ausübung der aktiven Funktionen. Der Energiebedarf für den Funktionsstoffwechsel ist höher als der für den Strukturstoffwechsel. Unterschreitet der zerebrale Blutfluss bzw. die Energiezufuhr die so genannte Funktionsschwelle, stellen die Hirnzellen ihre aktive Funktion zunächst reversibel ein. Es kommt zur Ischämie. Dieser Zustand kann jedoch nur eine bestimmte Zeit aufrechterhalten werden. Bei länger anhaltender Ischämie entsteht ein Infarkt, da die Zellstruktur nicht länger erhalten werden kann. Sinkt der zerebrale Blutfluss bzw. die Energiezufuhr weiter und unter die so genannte Infarktschwelle, werden die Hirnzellen ebenfalls irreversibel geschädigt und sterben ab, so dass ein Infarkt entsteht. EmbolienAls Embolie wird die Verschleppung von Partikeln mit dem Blutstrom bezeichnet. Der ischämische Schlaganfall embolischer Genese wird durch einen Verschluss einer oder mehrerer hirnversorgender Arterien verursacht. Diese Partikel können aus unterschiedlichen Bestandteilen bestehen. Nach den Hauptbestandteilen wird die Embolie entsprechend beispielsweise als Thromboembolie oder als Fettembolie bezeichnet.[3] Meist sind Thromboembolien für die Entstehung ischämischer Schlaganfälle verantwortlich. Der Embolus stammt dann entweder aus dem Herzen (kardiale Embolie) oder aus den hirnversorgenden Arterien selbst (arterio-arterielle Embolie). Verschiedene Herzerkrankungen wie Vorhofflimmern, Erkrankungen der Herzklappen, akute Herzinfarkte, koronare Herzkrankheit, Herzinsuffizienz und eine Vergrößerung der Herzkammern (ventrikuläre Hypertrophie) erhöhen das Risiko für kardiale Embolien.[5] Zu den kardialen Embolien gehören auch die paradoxen Embolien, die bei Patienten mit venösen Thrombosen und persistierendem Foramen ovale entstehen können.[6] Arterio-arterielle Embolien gehen aus arteriosklerotischen Veränderungen der Arterien hervor. Häufiger Ursprung sind die Aorta, die Karotisgabel und die linke und rechte Halsschlagader.[5] ThrombosenAls Thrombosen werden Blutgerinnsel in Gefäßen bezeichnet. Hirninfarkte können durch Thrombosen der hirnversorgenden Arterien ausgelöst werden. Die meisten arteriellen Thrombosen entstehen an solchen Stellen des Gefäßsystems, an denen arteriosklerotischen Veränderungen der Gefäßwand bestehen. Sie können aber auch bei Gefäßverletzungen der Innenseite der Gefäßwand (Tunica intima) entstehen. Dies ist beispielsweise bei Dissektionen der Fall, bei denen es durch einen Einriss der inneren Gefäßwand zu Einblutungen in die Gefäßwand kommt (zwischen Tunica intima und Tunica media). Andere Ursachen für arterielle Thrombosen sind Entzündungen der Gefäßwände (Vaskulitiden) und Gerinnungsstörungen sowie Fremdkörper innerhalb des Gefäßes, beispielsweise Stents und Gefäßprothesen.[3] Arterielle Thrombosen können langsam oder schnell entstehen. Langsam entstehende Thrombosen sind erst bei hochgradiger Einengung (Stenose) des Gefäßinneren hämodynamisch relevant, das heißt, dass der Blutfluss erst dann nicht mehr für die Versorgung des Hirngewebes ausreicht.[3] Hämodynamische MechanismenReicht der zerebrale Blutfluss zur Versorgung des Hirngewebes nicht aus, kann es zum ischämischen Schlaganfall kommen. Dies kann wie im Abschnitt Thrombosen beschrieben durch eine lokale Engstelle der Fall sein oder bei systemischen Störungen des Blutflusses, wie einer schweren Hypotonie beispielsweise nach einem Herzinfarkt, bei dem die Auswurfleistung des Herzens vermindert sein kann.[3] Risikofaktoren des SchlaganfallsDie wichtigsten, in großen Studien gesicherten Risikofaktoren für den ischämischen Schlaganfall sind:
EinteilungenNeben Einteilungen nach Ätiologie und Pathogenese sind zahlreiche weitere Einteilungen möglich. Verbreitet sind Einteilungen nach zeitlichem Verlauf, nach dem Infarktmuster in der Bildgebung, nach dem betroffenen Hirnstromgebiet und nach der Schwere der Symptome. Einteilung nach zeitlichem VerlaufEs wurde in der Vergangenheit eine Unterteilung des Schlaganfalls nach dem zeitlichen Verlauf in folgende Stufen vorgenommen:
Das Gehirn ist in der Lage, Schäden am Gehirngewebe und die damit einhergehenden Symptome teilweise auszugleichen, indem andere Gehirnzellen die Funktion der abgestorbenen übernehmen. Diese so genannte Plastizität ist abhängig von verschiedenen Faktoren wie z. B. dem Alter des Patienten oder der Art der Erkrankung. Allerdings besteht in den meisten Fällen die Ursache (wie Arteriosklerose oder Vorhofflimmern) des Schlaganfalls weiter, die daher konsequent behandelt werden muss. Einteilung nach Infarktmuster in der BildgebungEs kann zwischen Territorialinfarkten, Grenzzoneninfarkten und lakunären Infarkten unterschieden werden. Territorialinfarkte entstehen durch embolischen Verschluss hirnversorgender Arterien und betreffen das Versorgungsgebiet (Territorium) des Gefäßes. Lakunäre Infarkte sind kleiner als 1,5 cm. Sie entstehen meist durch mikroangiopathische Veränderungen. Grenzzoneninfarkte sind hämodynamischer Genese. Sie entstehen meist durch Verschluss der großen extrakraniellen Gefäße oder durch einen passageren Blutdruckabfall bei vorbestehenden Einengungen der Halsschlagadern.[9] Symptome Beim ischämischen Schlaganfall kommt es typischerweise zu einem plötzlichen Auftreten mehrerer Symptome. Die Symptomatik kann auch fluktuieren oder allmählich zunehmen. Die Symptomatik erlaubt aber keine Differenzierung der Ursachen eines Schlaganfalls.
Weitere Leitsymptome, die typisch für einen Hirninfarkt sind:
Schlaganfälle im vorderen Stromgebiet
Die folgenden Symptome können bei einseitigen Infarkten der Arteria carotis interna (ACI) (50 % aller Insulte), Arteria cerebri media (ACM) (25 % der Fälle) und bei Infarkten von Gefäßen, die aus diesen abgehen (Teilinfarkte), auftreten. Bei Infarkten auf beiden Seiten finden sich die gleichen Symptome, ausgeweitet auf beide Körperhälften:
Schlaganfälle im hinteren StromgebietDer hintere Teil des Großhirns sowie Hirnstamm, Brücke und Kleinhirn werden aus den Arteriae vertebrales versorgt, die sich zur unpaaren Arteria basilaris vereinigen. Aus dieser entspringt beidseits die Arteria cerebri posterior (sog. hinterer Hirnkreislauf), die in etwa 10 % infarziert ist. Bei einem Infarkt im Bereich des hinteren Hirnkreislaufes können auftreten:
Diagnose und Differentialdiagnose Sowohl beim hämorrhagischen als auch beim ischämischen Schlaganfall handelt es sich um eine äußerst zeitkritische Diagnose. Relativ häufig kommt es jedoch zu einer Verzögerung im Aufsuchen ärztlicher Hilfe, sei es durch die Schmerzfreiheit des Krankheitsbildes, weil aufgrund der einschränkenden Symptomatik keine Hilfe gerufen werden kann, oder auch weil der Schlaganfall zuerst während des Schlafes auftritt. In diesen Fällen werden die Notfalldienste häufig erst durch besorgte Angehörige alarmiert.[10] Aus der oben beschriebenen Problematik ergibt sich die Dringlichkeit der raschen ärztlichen Evaluation zur potenziellen Indikation einer Lysetherapie, deren wirksames Zeitfenster allgemein als 4,5 Stunden nach Symptomeintritt angesehen wird. Auch innerhalb dieses Zeitfensters für die Anwendung von Maßnahmen, welche geeignet sind die Blutversorgung wiederherzustellen, hat sich gezeigt, dass zur Minimierung bleibender Schäden ein frühestmöglicher Therapiebeginn angestrebt werden sollte. In der Darstellung fast aller Schlaganfall-Formen haben sich moderne MRT-Geräte mit spezialisierten, perfusions-diffusions-gewichteten und anderen spezialisierten Sequenzen (FLAIR, T2*) als überlegen erwiesen, aufgrund der häufig jedoch schlechteren Verfügbarkeit bei längerer Untersuchungsdauer ist die Notfalldiagnostik bei entsprender Anamnese und klinischem Bild nach wie vor häufig das CCT. Dieses eignet sich prinzipiell zum schnellen Ausschluss der primären Kontraindikationen der Lysetherapie mit RtPA, dem Vorliegen einer intracraniellen Blutung sowie eines Hirntumors. Besonders bei unklarem Symptombeginn ist das MRT jedoch in der Lage, durch Bestimmung eines Perfusions-Diffusions-Mismatchs, also die Darstellung eines Areals, über dem die perfusionsgewichtete Bildgebung schon auffällig, die diffusionsgewichtete jedoch noch nicht auffällig ist, einen Eindruck des schon geschädigten in Relation zum noch zu schädigenden Areal (Penumbra) zu geben.[10] Weitere Diagnostik kann, bei entsprechendem Anlass, umfassen:
Die differentialdiagnostischen Möglichkeiten beim ischämischen Schlaganfall sind vielfältig:
 TherapieAufnahme in Stroke UnitSchon zur Erstversorgung von Patienten mit Schlaganfall (Apoplex) oder mit Schlaganfallverdacht sollte nach Möglichkeit die Krankenhausaufnahme auf einer Spezialstation für Schlaganfallpatienten, einer so genannten Stroke Unit (Schlaganfalleinheit) erfolgen. Das erste Ziel dort ist es, dem Patienten eine rasche und optimale Diagnostik zu bieten, um die optimale Therapie festzulegen. Die weitere Behandlung basiert auf einer intensiven laufenden Überwachung des Patienten. Kontinuierlich werden die Basisparameter von Blutdruck, Puls, Temperatur, Blutzucker und Atmung kontrolliert. Die Schlaganfallursache muss frühestmöglich geklärt und gezielte Maßnahmen gegen weitere Schlaganfälle ergriffen werden. Die enge Zusammenarbeit verschiedener medizinischer Disziplinen wie Neurologen, Internisten, Neurochirurgen und Radiologen ist ein weiterer Vorteil der Schlaganfall-Einheit wie auch die frühzeitige Einleitung einer längerfristig angelegten Rehabilitation (Krankengymnastik, Ergotherapie, Physiotherapie, Sprachtherapie, Hilfsmittelversorgung).[12] Lysetherapie (Thrombolyse)Sprechen keine Kontraindikationen wie eine Hirnblutung dagegen, ist die unverzügliche intravenöse Thrombolyse innerhalb von 4,5 Stunden nach Symptombeginn die etablierte Standardtherapie, um das Blutgerinnsel (den Thrombus) aufzulösen (Lyse-Therapie), das minderversorgte Hirngebiet wieder zu durchbluten und die Spätfolgen einzudämmen.[13][14] Je eher die Therapie begonnen werden kann, desto besser („time is brain“). Es wird zwischen einer systemischen Lysetherapie (Medikament wird im gesamten Kreislauf verteilt) und einer lokal angewendeten Lysetherapie unterschieden. Die größte Gefahr im Rahmen der Lysetherapie sind sekundäre Blutungen. Diese können auftreten, weil die Blutgerinnung für Stunden gehemmt wird. Dadurch kann es sowohl zu Einblutungen im Gehirn mit weiterer Verschlechterung des neurologischen Status kommen als auch zum Blutverlust über andere Wunden. In einer amerikanischen und in europäischen Studien (z. B. European Cooperative Acute Stroke Study – ECASS) wurden die positiven Effekte einer systemischen Lysetherapie bei Patienten mit einem ischämischen Schlaganfall gezeigt. Bei einigen Patienten kann auch nach dem 4,5-Stunden-Fenster (oder bei unklarem Symptombeginn, z. B. bei Erwachen aus dem Schlaf (Wake-up Stroke)) eine Lyse sinnvoll sein, wenn die Größe der tatsächlichen Gewebsschädigung und das Ausmaß der bestehenden Durchblutungsstörung voneinander abweichen (sog. Diffusions-Perfusionswichtungs-Mismatch).[15] Eine MRT-Untersuchung, die mindestens genau so sensitiv ist wie eine Computertomografie, sollte aber nicht zu einer wesentlichen Verzögerung des Therapiebeginns führen, denn je früher eine Lysetherapie beginnt, desto effektiver ist sie. Neben dem seit Jahrzehnten bewährten Standardpräparat rt-PA hat Anfang 2024 Tenecteplase die Zulassung für die Behandlung des Schlaganfalles erhalten und gilt als mindestens gleichwertig.[13][16] Mechanische ThrombektomieLiegt dem Schlaganfall ein Verschluss eines großen Hirngefäßes zugrunde (z. B. Hauptstamm der A. cerebri media) kommt zur Rekanalisation neben der intravenösen Thrombolyse zusätzlich die mechanische Thrombektomie zum Einsatz.[13] Es handelt sich um ein endovaskuläres Verfahren, bei dem ein Katheter meist von der Oberschenkelarterie kommend bis zu den Hirngefäßen vorgeschoben wird. Für die Thrombektomie an den Hirngefäßen werden spezielle Rekanalisationssysteme (sog. Stent-Retriever) verwendet. AtmungEs sollte auf eine ausreichende Sauerstoffsättigung des Blutes geachtet werden. Gesicherte Daten aus prospektiven Studien liegen derzeit nicht vor. Bei nicht intubationspflichtigen Patienten empfiehlt die DGN die Gabe von Sauerstoff nur bei schweren Symptomen, einer peripheren Sauerstoffsättigung unter 95 % und in einer Dosierung von 2 bis 5 Litern / Minute[17] über Nasensonde.[18] Die generelle Gabe von Sauerstoff wurde 2012 kontrovers diskutiert.[19] Bei Vorliegen pathologischer Atemmuster, klinische oder laborchemischen Hinweisen auf eine respiratorische Insuffizienz, Aspirationsgefahr oder zunehmender Eintrübung des Bewusstseins besteht die Indikation zur Beatmung.[20] BlutdruckKommen eine intravenöse Thrombolyse oder mechanische Rekanalisation zum Einsatz, sollte der Blutdruck rasch unter 180 mmHg systolisch gesenkt werden, eine Absenkung unter 140 mmHg kann erwogen werden.[13] Ohne rekanalisierende Therapie sollte der Blutdruck nicht zu weit und zu schnell gesenkt werden, insbesondere nicht bei Patienten mit vorbestehendem Bluthochdruck. Es soll damit versucht werden, durch einen erhöhten Blutdruck die Durchblutung im Bereich der Penumbra aufrechtzuerhalten, da die Autoregulation des Blutdrucks in diesem Bereich gestört ist und daher die Durchblutung vom systemischen arteriellen Blutdruck abhängig ist. Durch unangepasste Senkung des Blutdrucks kann es zu einer Verschlechterung der Symptomatik kommen. Umgekehrt kann es auch nötig werden, den Blutdruck medikamentös auf hochnormale Werte anzuheben. ThromboseprophylaxeDa Schlaganfallpatienten mit ausgeprägteren Lähmungserscheinungen ein deutlich erhöhtes Risiko für Thrombosen und Lungenembolien haben, muss von Beginn an eine ausreichende Thromboseprophylaxe durchgeführt werden. Dies kann mit Na- oder Ca-Heparin s. c. oder niedermolekularem Heparin s. c. durchgeführt werden. Zusätzlich werden Medizinische Thromboseprophylaxestrümpfe (MTPS) verwendet und die frühe Mobilisation als Thromboseprophylaxe angestrebt. BlutzuckerEs wird eine Normoglykämie bzw. ein hochnormaler Blutzuckerwert (also ein Blutzuckerwert kleiner 8,9 mmol/l [160 mg/dl]) angestrebt. Hierbei denkt man v. a. an den Gehirnstoffwechsel, wobei sowohl Hypo- als auch Hyperglykämien negative Auswirkungen auf die Überlebensfähigkeit der Nervenzellen haben. KörpertemperaturEine erhöhte Körpertemperatur oder Fieber kann die Prognose nach einem ischämischen Schlaganfall verschlechtern. Es wird empfohlen, Körpertemperaturen über 37,5° aktiv mit fiebersenkenden Medikamenten (Antipyretika) zu senken.[18] Kontrollierte Studien zur aktiven Senkung einer erhöhten Körpertemperatur mittels medikamentöser Behandlung oder Kühlung, die einen positiven Effekt der induzierten Hypothermie unter klinischen Bedingungen zeigen, fehlen jedoch.[21][22] Die Erhöhung der Körpertemperatur kann zentral oder durch Infektionen bedingt sein. Es wird eine Infektsuche empfohlen,[23] allerdings keine prophylaktische antibiotische Therapie.[21] HirnödemIm und angrenzend an das Inafarktareal kann sich eine Schwellung des Hirngewebes ausbilden, die aufgrund der knöchernen Begrenzung des Schädels zu einem Anstieg des intrakraniellen Druckes und zu einer Schädigung gesunder Hirnareale beitragen kann.[24] Um dem entgegenzuwirken, wird empfohlen, Fieber zu senken, den Oberkörper leicht aufrecht zu positionieren, epileptische Anfälle zu unterdrücken und ggf. drucksenkende Medikamente (z.M. Mannitol oder Sedativa) einzusetzen. Steigt der Hirndruck und ist dieser voraussichtlich oder akut medikamentös nicht mehr zu beherrschen, so kommt die neurochirurgische Dekompression in Form der Hemikraniektomie in Betracht (z. B. beim raumfordernden, so genannten malignen Mediainfarkt). Entscheidend ist die frühzeitige Entscheidung zu einer solchen Dekompressionsoperation, d. h. bereits wenige Tage nach dem Schlaganfallereignis, wenn sich eine massive Schwellung anbahnt (und nicht erst, wenn die Schwellung voll ausgeprägt ist). In mehreren großen randomisiert-kontrollierten Studien (DECIMAL, DESTINY und HAMLET) konnte gezeigt werden, dass bei Patienten unter 60 Jahren die Überlebenschancen und die Chancen auf eine weniger stark ausgeprägte Behinderung bei malignem Hirninfarkt durch eine Hemikraniektomie deutlich erhöht werden.[25] Allerdings steigt auch der Anteil der auf Hilfe angewiesenen Patienten mit schweren Behinderungen an, so dass empfohlen wird, den mutmaßlichen Willen des Patienten in die Therapieentscheidung miteinzubeziehen.[26] Auch bei Patienten über 60 scheint eine Hemikraniektomie die Überlebenschance deutlich zu steigern, wie in einer weiteren randomisiert-kontrollierten Destiny-II-Studie[27], deren Ergebnisse 2014 veröffentlicht wurden, gezeigt werden konnte. Ein Drittel dieser älteren Patienten behielten schwere Behinderungen zurück und werden dauerhaft auf fremde Hilfe angewiesen sein.[28] ProphylaxeDie Behandlung der Risikofaktoren (s. o.) gehört zur Sekundärprävention weiterer Infarkte zwingend zur Therapie. Zweitinfarkte haben eine wesentlich schlechtere Prognose als der Primärinfarkt. Zur Verhütung weiterer Schlaganfälle erfolgt in der Regel eine Medikation mit ASS. Nur bei einem erhöhten Rezidivrisiko (z. B. anhand des ABCD2-Scores) kann in den ersten Wochen eine Kombination mit einem P2Y12-Inhibitor (z. B. Clopidogrel) erfolgen.[29] Sofern es sich um einen kardioembolischen Schlaganfall handelt, wird hingegen eine orale Antikoagulation erforderlich. Liegt ursächlich eine Verengung (Stenose) einer Halsschlagader vor, empfehlen die derzeitigen Leitlinien, eine operative oder eine interventionelle radiologische Therapie in Form einer Stentangioplastie zur Entfernung der Stenose („Carotis-Desobliteration“) durchzuführen. Die SPACE-Studie hat gezeigt, dass beide Therapien ähnliche Erfolge verbuchen, wobei die Operation einen leichten Vorteil zu besitzen scheint. Wichtig ist, dass eine Operation möglichst frühzeitig, d. h. wenige Tage nach dem Schlaganfall oder der TIA erfolgen sollte, denn nur so überwiegt der Nutzen die Operationsrisiken. In einer Untersuchung belegten irische Forscher, dass das Schlaganfallrisiko aufgrund eines beliebigen belastenden Lebensereignisses um 17 Prozent erhöht war, während das Auftreten von zwei oder mehr belastenden Lebensereignissen das Schlaganfallrisiko sogar um bis zu 31 Prozent erhöhen kann. Dabei wiesen sie unterschiedliche Stressfaktoren nach – sowohl erhöhter Stress am Arbeitsplatz als auch in der Familie oder belastende Lebensereignisse in jüngster Zeit – wie beispielsweise eine Trennung oder Scheidung, größere innerfamiliäre Konflikte oder Krankheiten und Todesfälle innerhalb der Familie – waren mit einem erhöhten Risiko für Schlaganfälle verbunden.[30] Zur Reduktion von Stress empfiehlt die Deutsche Schlaganfall-Gesellschaft Entspannungstechniken wie Achtsamkeitsmeditation, autogenes Training, viel Bewegung und eine Reduktion der privaten Stressfaktoren. All diese Maßnahmen verstärkten das Gefühl von Selbstwirksamkeit, führen zu erhöhter Resilienz und beugen Stress – und damit auch potentiellen Schlaganfällen – vor.[31] Komplikationen
RehabilitationIn der Nachbehandlung des Schlaganfalles wird versucht, verlorene Fähigkeiten wieder zu erlernen, so dass der Schlaganfallpatient sein Leben selbständig meistern kann. Teilweise können andere Regionen des Gehirns die Funktionen der ausgefallenen Bereiche übernehmen. Traditionell wird mit Hilfe der Physiotherapie, Ergotherapie, Logopädie und Neuropsychologie versucht, den Patienten zu helfen (u. a. frühestmögliche Pflege und Therapie nach dem Bobath-Konzept), weiterbehandelnde Rehabilitationskonzepte sind die Spiegel- und die Videotherapie. PrognoseEin Teil der Schlaganfallpatienten fällt ins Koma oder stirbt. Ein Jahr nach einem Schlaganfall (im weiteren Sinne) leben noch 60 % der Patienten. 64 % der Patienten, die das erste Jahr überleben, sind auf fremde Hilfe angewiesen. 15 % von ihnen müssen in Pflegeeinrichtungen versorgt werden.[2] Das durchschnittliche jährliche Risiko eines erneuten Schlaganfalls liegt für etwa fünf Jahre bei 6 %. In den ersten 6 Monaten nach einem Schlaganfall beträgt es 9 %, im ersten Jahr liegt es zwischen 13 und 14 % und fällt dann in den folgenden Jahren auf 4–5 % ab.[8] Die Fälle, in denen die Symptome nach kurzer Zeit wieder verschwinden (siehe TIA), sollten für den Betroffenen Anlass sein, sich ärztlich über vorbeugende Maßnahmen beraten zu lassen, um ein erneutes evtl. bleibendes Auftreten zu verhindern. Abgestorbene Nervenzellen können zwar nicht mehr nachgebildet werden, aber andere Teile des Gehirns können durch Lernprozesse auch noch nach einigen Wochen die verlorene Funktion übernehmen. Eine frühe Rückbildung gibt eine günstige Prognose. Literatur
Weitere Literatur
Leitlinien:
Patientenratgeber:
Zur Stroke Unit:
Erfahrungsbericht:
WeblinksWikibooks: Erste Hilfe bei Schlaganfall – Lern- und Lehrmaterialien
Commons: Ischämischer Schlaganfall – Sammlung von Bildern, Videos und Audiodateien
Einzelnachweise, Fußnoten
Anmerkungen |
||||||