|
Humane Rotaviren
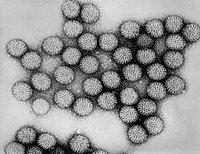
 Humane Rotaviren sind beim Menschen vorkommende Viren der Gattung Rotavirus (Familie Reoviridae, Unterfamilie Sedoreovirinae). Ihr Name rührt von der radähnlichen Struktur (lateinisch rota ‚das Rad‘) der Viren, die sich unter dem Elektronenmikroskop zeigt.[3] Sie wurden 1973 von Ruth Bishop durch Dünndarmbiopsien erkrankter Kinder entdeckt.[4] Rotaviren sind die häufigste Ursache für schwere Durchfallerkrankungen, sie tragen jährlich zu etwa 140 Millionen Fällen weltweit bei. Von allen klinisch relevanten Durchfallerkrankungen gehen 35 bis 52 % auf Rotaviren zurück. Zur Prävention stehen Impfstoffe zur Verfügung. Rotaviren sind auch im Tierreich weitverbreitet. Rotavirusinfektionen von Kälbern haben große wirtschaftliche Auswirkungen. Aufbau der RotavirenHumane Rotaviren sind 76 nm große RNA-Viren mit einem doppelschaligen ikosaedrischen Kapsid. Eine Virushülle ist nicht vorhanden. Das Genom besteht aus elf doppelsträngigen RNA-Segmenten von 0,6 bis 3,3 kb Länge. Jedes dieser Segmente codiert ein virales Protein. Durch die Segmentierung des Genoms besteht die Möglichkeit der Reassortantenbildung.[5] KlassifikationHumane Rotaviren gehören zur Familie der Reoviridae, Unterfamilie Sedoreovirinae. Insgesamt sind neun Spezies innerhalb der Gattung Rotavirus bekannt, bezeichnet mit Rotavirus A bis Rotavirus J * (International Committee on Taxonomy of Viruses (ICTV), Stand 2020).[6] Menschen infizieren sich hauptsächlich mit den Spezies A, B und C, am häufigsten mit Spezies A. Letztere ist mithin die klinisch wichtigste.[3] Die Spezies A bis E * verursachen auch bei Tieren Krankheiten,[7] so etwa Spezies E und H bei Schweinen, Spezies D, F und G bei Vögeln, Spezies I bei Katzen und Spezies J bei Langflügelfledermäusen.[8][9][10][11] Bei der Klassifizierung der Serotypen innerhalb der Spezies Rotavirus A[12] wurde ursprünglich, ähnlich wie im Fall des Grippevirus Influenzavirus A,[13] ein duales System angewandt, das auf der Reaktivität der Epitope zweier Proteine auf der Oberfläche des Virions basierte, wobei das Glycoprotein VP7 die G-Serotypen und das protease-sensitive Protein VP4 die P-Serotypen definierte.[14] Es wurde durch ein G-/P-Genotyp-System abgelöst.[14] Hierbei werden die Gene von VP4 und VP7 klassifiziert. Da die beiden Gene, welche G- und P-Genotypen bestimmen, getrennt an die Tochterviren weitergegeben werden können, finden sich – wie bei Influenza – unterschiedliche Kombinationen.[14] Für Rotaviren der Gruppe A wurde ein Typisierungssystem für das gesamte Genom aufgestellt, das zur Bestimmung der Herkunft atypischer Linien verwendet werden kann.[15] Die Verbreitung von Rotaviren der einzelnen G- und P-Typen variiert wie bei den H/N-Typen der Grippeviren von Land zu Land und von Jahr zu Jahr.[16] Die G- und P-Antigentypen sind variabel kombinierbar.[3] Ist der G-Genotyp bekannt, wird dieser durch eine arabische Zahl dargestellt (z. B. G1), ein bekannter P-Genotyp wird mit einer arabischen Zahl in eckigen Klammern angegeben (z. B. P[8]).[14][7] Es sind 32 G- und 51 P-Typen bekannt,[17] humanpathogen sind nur wenige Kombinationen (G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] und G12P[8]).[18] ÜbertragungDie Infektion mit Rotaviren erfolgt meist auf gewöhnlichem fäkal-oralem Weg, wobei kontaminierte Lebensmittel und kontaminiertes Trinkwasser eine Rolle spielen können. Die Möglichkeit einer Übertragung durch Aerosole lässt sich experimentell nachweisen.[19] Im Anschluss an eine schwere Erkrankung wird der Erreger üblicherweise für ca. eine bis drei Wochen ausgeschieden. Die Ausscheidung kann jedoch bis zu acht Wochen,[20] bei Patienten mit Immundefizienz noch länger dauern.[21] Der Erreger kann tagelang auf Oberflächen und wochenlang in Wasser aktiv bleiben (hohe Tenazität). Auch auf Händen kann der Erreger überdauern.[22] Die hohe Durchseuchung bereits im Kindesalter resultiert aus der geringen Infektionsdosis von nur zehn Viruspartikeln, der hohen Konzentrationsdichte im diarrhöischen Kot (etwa 1011 infektiöse Partikeln pro Milliliter) und der hohen Umwelttoleranz des Erregers.[3] EpidemiologieRotaviren sind weltweit verbreitet. Vor der Einführung der Rotavirus-Impfungen haben bis zum Ende des dritten Lebensjahres die meisten Kinder (> 90 %) bereits eine Infektion durchgemacht. In Deutschland werden im Schnitt pro Jahr etwa 50.000 Erkrankungsfälle gemeldet.[23] In den gemäßigten Zonen treten die meisten davon zwischen Februar und April auf, in den Tropen hingegen unterliegt die Inzidenz keinen signifikanten Schwankungen im Jahresverlauf.[3] Innerhalb der ersten Lebensjahre werden infolge von Kontakten mit Rotaviren zunehmend Antikörper gebildet. Frühere Erkrankungen können bei einer späteren Reinfektion mit denselben bzw. anderen Rotaviren-Typen vor einer neuerlichen Erkrankung schützen. Zwar erkrankt man, wenn überhaupt, nur leicht, doch scheiden Infizierte infektiöse Viren aus und sind damit Überträger.[3] Im Erwachsenenalter äußern sich Erkrankungen vor allem als Reisediarrhoe, wobei nur ca. 20 % der Reisediarrhoen durch Rotaviren entstehen. Die schwersten Krankheitsverläufe sind in der Altersgruppe zwischen sechs Monaten und zwei Jahren zu beobachten. In den gemäßigten Klimazonen ereignen sich Rotavirusinfektionen vorwiegend während der Wintermonate. Außer Kindern erkranken vor allem Ältere oder Immunsupprimierte schwer. Nach Schätzungen der Weltgesundheitsorganisation starben 2004 etwa 527.000 Kinder unter fünf Jahren an einer Rotavirus-induzierten Dehydratation bzw. Gastroenteritis, hauptsächlich in Entwicklungsländern.[24] Nach der Einführung der Impfstoffe 2006 verringerte sich die Zahl der Todesfälle: So starben 2008 etwa 453.000 Kinder unter fünf Jahren, 2013 etwa 215.000 Kinder unter fünf Jahren.[25] In Deutschland sind durch eine viral bedingte Einstülpung des Darmes[26] verursachte Todesfälle äußerst selten.[27] Krankheitsbilder und PhysiologieNach einer Inkubationszeit von ein bis drei Tagen treten die klinischen Symptome auf.[3] Die Infektion kann aber auch klinisch inapparent, d. h. ohne Symptome verlaufen. Häufig beginnen die Symptome mit Erbrechen, gefolgt von mäßigem Fieber und nichtblutigem Durchfall; Bauchschmerzen sind dagegen selten.[3] Bei schweren Krankheitsverläufen kann der Durchfall vier bis fünf Tage andauern und durch damit verbundenen Wasser- und Elektrolytverlust zur Exsikkose führen, die potentiell lebensbedrohlich ist. Diese und die auftretende metabolische Azidose können zu Herzrhythmusstörungen bis zum Herzstillstand führen.[3] Die übliche Erkrankungsdauer beträgt sechs bis acht Tage. Bei Kleinkindern kann die Infektion mit Rotaviren auch zu einer Intussuszeption des Darmes als besonderer Komplikation führen, die operativ behandelt werden muss. Zudem können die Viren ins Blut gelangen (Virämie) und Nieren und Leber befallen.[3] Die Vermehrung der Erreger findet in den apikalen Enterozyten der Dünndarmzotten statt. Vermutlich wird durch das virale Protein (NSP4), das Eigenschaften eines Enterotoxins aufweist, die pathogene Wirkung verstärkt. Nach etwa 10 bis 14 Tagen endet die Ausscheidung von Viren, Immunkompromittierte leiden dagegen monatelang an Durchfällen und damit einhergehender Virusausscheidung.[3] DiagnoseDie diagnostische Untersuchung auf Rotaviren erfolgt aus dem Stuhl meist mit einem Immunassay, der spezifisch ein Kapsidprotein als Antigen nachweist. Antigentests haben oft nur geringe analytische Sensitivität. Doch in der akuten Erkrankungsphase ist viel virales Antigen im flüssigen Stuhl vorhanden, sodass die Testempfindlichkeit reicht, um Rotaviren als Ursache zu bestätigen. Das Virus ist bei längerfristiger Ausscheidung ohne akute Infektionszeichen wegen geringer Antigenmenge mittels Antigentest nicht zu bestätigen. Einfach ist der Nachweis im Stuhl mittels Elektronenmikroskopie, da die Rotaviren an ihrer typischen Morphologie gut zu erkennen sind. Für spezielle Fragestellungen zum Ausscheiderstatus oder zur Bestimmung der Subtypen für epidemiologische Untersuchungen ist eine RT-PCR zu empfehlen. Nur noch selten wird eine klassische Virusisolierung, RNA-Elektrophorese oder Nukleinsäurehybridisierungsreaktion verwendet. Schnelltestverfahren zum Nachweis von Antigen sind zwar möglich, aber aufgrund geringer Sensibilität und nicht ausreichender Spezifität (falsch positive Ergebnisse) nur eingeschränkt verwertbar. Serologische Methoden zum Nachweis spezifischer Antikörper gegen Rotaviren haben diagnostisch keine Bedeutung. ProphylaxeAls Prophylaxemaßnahme dient die Einhaltung allgemeiner Hygienestandards sowie die Isolierung von Patienten bei einer stationären Aufnahme, eventuell in einer Kohortenisolierung. Aufgrund der hohen Tenazität des Erregers ist eine hohe Compliance essentiell, zur Oberflächendesinfektion sollten viruzide Mittel verwendet werden.[3] ImpfungIn Europa stehen zwei verschiedene Rotavirusimpfstoffe zur Verfügung: ein monovalenter Impfstoff RV1 (Rotarix von GlaxoSmithKline) sowie ein pentavalenter Impfstoff RV5 (RotaTeq von Sanofi Pasteur MSD).[28] Das Impfschema besteht aus zwei bzw. drei Teilimpfungen. Es handelt sich um Schluckimpfungen. Die Immunisierung muss mit der vollendeten 24. (Rotarix) bzw. 32. (RotaTeq) Lebenswoche abgeschlossen sein. Im August 2013 wurde die Rotavirusimpfung in den Impfkalender der STIKO aufgenommen und wird in Deutschland für Säuglinge ab einem Alter von sechs Wochen empfohlen.[29][30] Ohne Impfung erkrankt bis zum fünften Lebensjahr nahezu jedes Kind an Rotaviren.[31] Neben dem Schutz vor der Rotavirusinfektion gibt es in den USA auch Hinweise auf einen Rückgang von Krampfanfällen nach Rotavirusimpfung.[32] In Indien ist seit 2014 ein dritter, monovalenter Impfstoff zugelassen: Rotavac.[33] RV1, RV5 sowie Rotavac sind von der WHO vorqualifiziert und gelten als sicher und wirksam.[33] Ferner sind in einzelnen Länder weitere Impfstoffe lokal zugelassen. Eine Schluckimpfung gegen Rotaviren (RotaShield von Wyeth Lederle) wurde 1998 in den USA in den normalen Impfplan aufgenommen, am 15. Oktober 1999 jedoch wieder zurückgezogen, nachdem landesweit 76 Fälle einer Intussuszeption (Darmeinstülpung) aufgetreten waren und ein möglicher Zusammenhang mit der Impfung angegeben wurde. Nach intensiven klinischen Studien sind seit dem 2. Quartal 2006 wieder Rotavirus-Impfungen für Kinder im Alter bis zu sechs Monaten in Europa und den USA zugelassen. Eine klinische Studie zu Rotarix – mit 615 untersuchten Intussuszeptionen aus Brasilien und Mexiko – wurde im Juni 2011 im New England Journal of Medicine publiziert.[34] In der Fallkontrollstudie wurde ein leicht erhöhtes Risiko konstatiert, aber für beide Länder eine positive Nutzen-Risiko-Bilanz. Laut einer Studie der australischen Therapeutic Goods Administration zeigte sich (ohne Differenzierung des Impfzeitpunkts) ein um den Faktor 3,5 (0,7–10,1) gesteigertes Risiko der Intussuszeption, während für RotaTeq ein um den Faktor 5,3 erhöhtes Risiko (1,1–15,4) gefunden wurde.[35] Harry Greenberg von der Stanford University deutete im NEJM die Resultate dahingehend, dass „Intussuszeptionen ein prinzipielles Risiko aller Rotavirus-Infektionen sind“, da beide Impfstoffe aus Lebendviren bestehen. Weil eine Impfung zu inapparenten Infektionen führt, könnte es aber sein, dass die Gefahr einer Erkrankung durch die Impfung geringer ist als bei einer Infektion mit dem Wildtyp. Das Risiko gilt aber als sehr gering, auf 100.000 geimpfte Säuglinge dürfte es zu einem bis fünf Zwischenfällen kommen.[36] TherapieEine spezielle Therapie existiert nicht, eine Therapie erfolgt rein symptomatisch. Es ist in jedem Fall auf eine ausreichende Flüssigkeitszufuhr (ggf. Elektrolytlösung) – oral oder parenteral – zu achten.[37] Von der Einnahme von Antidiarrhoika ist abzuraten, da diese die Ausscheidung des Erregers erschweren und somit den Krankheitsverlauf verlängern können. MeldepflichtDer Nachweis von Rotaviren ist in Deutschland nach § 7 Infektionsschutzgesetz (IfSG) namentlich meldepflichtig, darüber hinaus nach § 6 IfSG Verdacht auf und die Erkrankung […] an einer akuten infektiösen Gastroenteritis, wenn der oder die Betroffene Umgang mit Lebensmittel hat, in einer Gemeinschaftseinrichtung arbeitet oder wenn nach dem epidemischen Zusammenhang ein Ausbruch zu vermuten ist (wenn zwei oder mehr gleichartige Erkrankungen auftreten, bei denen ein epidemischer Zusammenhang wahrscheinlich ist oder vermutet wird).[38] Zudem haben Leitungen von Gemeinschaftseinrichtungen gemäß § 34 Abs. 6 und Abs. 1 IfSG das zuständige Gesundheitsamt unverzüglich zu benachrichtigen, wenn es in ihrer Einrichtung betreute Kinder [gibt], die das 6. Lebensjahr noch nicht vollendet haben und an infektiöser Gastroenteritis erkrankt oder dessen verdächtig sind. Fußnote* RVE noch nicht als eigenständige Spezies anerkannt Weblinks
Einzelnachweise
|