|
Citronellal
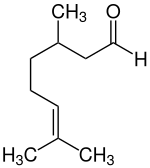
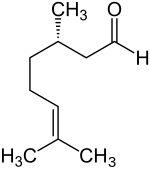
Citronellal, auch Rhodinal (Betonung jeweils auf der Endsilbe: Citronellal, Rhodinal) ist eine klare, viskose Flüssigkeit. Es handelt sich um ein Monoterpen-Aldehyd. IsomerieCitronellal kommt in Form zweier Enantiomere vor, dem (R)-(+)-Citronellal [auch kurz als (+)-Citronellal bezeichnet] und dem (S)-(−)-Citronellal [auch kurz als (−)-Citronellal bezeichnet]. Ein 1:1-Gemisch Racemat beider Enantiomere wird (RS)-(±)-Citronellal genannt.
Die Verbindung mit endständiger Doppelbindung wird als α-Citronellal[6] bezeichnet. Vorkommen (R)-Citronellal findet sich hauptsächlich in Zitruspflanzen und im Citronellöl, aber auch in Zitronenmelisse.[7][8] Das Öl der Blätter der Zitrone enthält zwischen 25.000 und 89.000 ppm, die Frucht der Limette etwa 140 und die Früchte des Gemeinen Wacholders etwa 160 ppm (R)-Citronellal. (S)-Citronellal ist mit etwa 80 Prozent Hauptbestandteil des ätherischen Öls der Blätter der Kaffernlimette sowie der Zitronenmyrte (Backhousia citriodora).[7] Das Racemat kommt in Konzentrationen bis zu 85 Prozent im Öl des Zitroneneukalyptus vor.[7] Andere Vorkommen sind in Ingwer (Zingiber officinale) und im Ceylon-Zimtbaum (Cinnamomum verum).[5] Gewinnung und DarstellungCitronellal lässt sich aus Pinenen herstellen. β-Pinen wird bei Temperaturen über 500 °C in Myrcen umformiert. Myrcen reagiert mit Diethylamin und Butyllithium. Das entstehende Chelat reagiert zu N,N-Diethylgeranylamin, welches an einem speziellen Katalysator zum (3r)-1E-1-Diethylamino-3,7-dimethyl-1,6-octadien umgelagert wird. Dieses wird zum Citronellal hydrolysiert. Die heterogen katalysierte Hydrierung von Citral in Gegenwart von Palladiumkatalysatoren führt normalerweise mit Citronellal nur als Zwischenstufe zum Dihydrocitronellal. In Gegenwart von ionischen Flüssigkeiten auf der Basis von nitrilfunktionalisierten Imidazoliumsalzen kann der zweite Hydrierschritt unterdrückt werden und so Citronellal als Hauptprodukt erhalten werden.[9] EigenschaftenDie Flüssigkeit siedet bei einem Normaldruck von 101,3 Kilopascal bei etwa 208 °C. Die Dichte beträgt etwa 0,85 g·cm−3. Es ist in Ethanol gut löslich, in Wasser und Glycerin hingegen kaum. Die molare Masse beträgt 154,25 g·mol−1. Der Flammpunkt liegt bei 78 °C. Verwendung Citronellal dient auch als Edukt für die Synthese von (1R,3R,4S)-(−)-Menthol. Hierbei bildet es zuerst mit Zinkbromid ein Chelat, das in Isopulegol umgewandelt wird, welches dann zum Menthol hydriert wird. Außerdem dient es zur Herstellung von Hydroxycitronellal, zu welchem es in Anwesenheit von Wasser reagieren kann. Es wird in billigen Duftstoffen, auch zur Parfümierung von Zigaretten und als Insektenabwehrstoff (Repellent) verwendet. Durch Kondensation mit 5-n-Pentyl-1,3-cyclohexandion gefolgt von einer Diels-Alder-Reaktion kann das Cannabinoid Hexahydrocannabinol stereoselektiv synthetisiert werden.[10] Das (R)-Epimer von Hexahydrocannabinol ist vergleichbar aktiv wie das Δ8-Tetrahydrocannabinol (Δ8-THC), das aber im Gegensatz zu Δ9-THC nur in geringen Mengen in Cannabis enthalten ist. RisikobewertungCitronellal wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Citronellal waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der vermuteten Gefahren durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2015 statt und wurde von Schweden durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[11][12] WeblinksSiehe auchEinzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||