|
Bradykinin
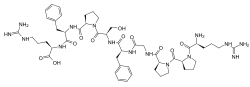
Bradykinin ist ein Peptid- und Gewebshormon der Kinin-Gruppe. Es handelt sich um ein vasoaktives, d. h. blutgefäßveränderndes, Oligopeptid, das aus neun Aminosäuren besteht und ähnlich wie Histamin wirkt. Bei Entzündungen oder Verletzungen ist es an der Schmerzempfindlichkeitssteigerung an der betroffenen Körperstelle beteiligt. Infolge seiner spezifischen Bindung an Rezeptoren im Gefäßendothel, verursacht es eine Tonusänderung der glatten Muskulatur (abhängig vom Wirkort), erhöht die Permeabilität des Gefäßes und verursacht Schmerz. StrukturDie Primärstruktur des Bradykinin besteht aus 9 Aminosäure-Resten (H2N-Arg–Pro–Pro–Gly–Phe–Ser–Pro–Phe–Arg-COOH) mit der Summenformel C50H73N15O11 und einer Molekülmasse von 1060,22 Da.[1] Synthese Bradykinin wird durch Kininogenasen wie Kallikrein aus seinen inaktiven Vorläuferproteinen, den Kininogenen, freigesetzt. Durch die Aktivität des Kinin-Kallikrein-Systems wird Bradykinin über eine proteolytische Spaltung seines Kininogen-Vorläuferproteins hochmolekulares Kininogen (HMW-Kininogen) mit Hilfe des Enzyms Kininogenase gebildet. MetabolismusDie Inaktivierung der Kinine erfolgt durch Abspaltung C-terminaler Dipeptide mittels Peptidyl-Dipeptidase, einem Enzym, das mit dem Angiotensin-konvertierenden Enzym (ACE) des Renin-Angiotensin-Aldosteron-Systems identisch ist. Beim Menschen wird Bradykinin durch verschiedene Enzyme abgebaut: durch das Angiotensin-konvertierende Enzym (ACE), Aminopeptidase P (APP), Carboxypeptidase N (CPN) und Neprilysin, welche die Positionen 7-8, 1-2, 8-9 bzw. 7-8 spalten.[2][3] Physiologische RolleRezeptorenBei Säugetieren sind zwei Arten von Bradykininrezeptoren bekannt. Der B1-Rezeptor wird nur infolge einer Gewebeverletzung exprimiert und spielt vermutlich eine Rolle bei chronischen Schmerzen. Der B2-Rezeptor ist konstitutiv aktiv und trägt zur gefäßerweiternden Wirkung von Bradykinin bei. WirkungenBradykinin ist ein potenter Endothel-abhängiger Vasodilatator, verursacht eine Kontraktion nicht-vaskulärer glatter Muskelzellen, erhöht die Gefäß-Durchlässigkeit (Permeabilität) und ist auch am Mechanismus von Schmerz beteiligt. In mancher Hinsicht hat es ähnliche Wirkungen wie Histamin und wird wie dieses vor allem aus Venolen und weniger aus Arteriolen freigesetzt. Bradykinin erhöht die intrazellulären Calciumspiegel in neokortikalen Astrozyten und führt dazu, dass diese Glutamat freisetzen.[4] Bradykinin soll auch die Ursache von trockenem Husten bei manchen Patienten unter einer Therapie mit ACE-Hemmern sein. Dieser refraktäre Husten ist eine häufige Ursache für die Notwendigkeit des Absetzens einer ACE-Hemmer-Therapie. Funktionen von Bradykinin
Geschichte Bradykinin wurde von drei brasilianischen Physiologen und Pharmakologen entdeckt, die am Instituto de Biologia de São Paulo, in São Paulo unter der Leitung von Maurício Rocha e Silva tätig waren. Zusammen mit den Mitarbeitern Wilson Teixeira Beraldo und Gastão Rosenfeld entdeckte er 1948 dessen starke hypotensive Wirkungen im Tiermodell. Bradykinin wurde im Blutplasma von Tieren nach Zugabe von Venom von Bothrops jararaca (Jararaca-Lanzenotter) entdeckt, das von Rosenfeld aus dem Butantan-Institut bereitgestellt wurde. Diese Entdeckung war Teil einer fortgesetzten Untersuchung zum Kreislaufschock und zu proteolytischen Enzymen im Zusammenhang mit der Toxikologie von Schlangenbissen, die von Rocha e Silva bereits 1939 begonnen wurde. Bradykinin sollte sich als neues autopharmakologisches Prinzip erweisen, das heißt als Substanz, die im Körper über eine metabolische Modifikation aus Vorläufersubstanzen freigesetzt wird, die pharmakologisch aktiv sind. Nach B. J. Hagwood, Rocha e Silvas Biografen, „hat die Entdeckung von Bradykinin zu einem neuen Verständnis vieler physiologischer und pathologischer Phänomene geführt, einschließlich des durch Venome und Toxine ausgelösten Kreislaufschocks.“ Die praktische Bedeutung der Entdeckung von Bradykinin wurde offensichtlich, als einer seiner Mitarbeiter an der Medizinischen Fakultät von Ribeirão Preto an der Universität von São Paulo, Sérgio Henrique Ferreira, einen Bradykinin-potenzierenden Faktor (BPF) im Gift von Bothrops entdeckte, der sowohl die Dauer als auch das Ausmaß der Wirkungen von Bradykinin auf die Gefäßerweiterung und den nachfolgenden Abfall des Blutdruckes deutlich verstärkt. Ausgehend von diesem Befund entwickelten Forscher von BMS das erste einer neuen Generation von hochwirksamen blutdrucksenkenden Arzneimitteln, die sogenannten ACE-Hemmer wie Captopril. Einzelnachweise
|
||||||||||||||||||||||||||||||