|
Aminopterin
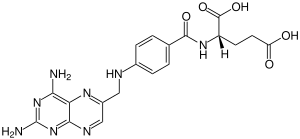
Aminopterin ist ein Analogon der Folsäure (Vitamin B9) und wirkt biologisch als Folsäure-Hemmstoff. Chemisch ist es ein synthetisches Pterin-Derivat mit antineoplastischen (gegen Krebs gerichtete) und immunsuppressiven Eigenschaften. Aminopterin wurde früher als Zytostatikum eingesetzt, ist aber heute weitgehend durch das strukturähnliche Methotrexat ersetzt. In der Zellkultur wird Aminopterin vielfach in Selektionsmedien insbesondere bei der Herstellung von monoklonalen Antikörpern eingesetzt. Bedeutung hatte die Verbindung durch eine große Rückrufaktion von Hunde- und Katzenfutter 2007 in den Vereinigten Staaten, bei der etwa hundert Fertigfuttermittel, auch von namhaften Herstellern, vom Markt genommen wurden. Die Kontamination mit Aminopterin wurde als mögliche Ursache für durch Futtermittel hervorgerufenes Nierenversagen diskutiert. AnwendungDie zytostatische Wirkung des Folsäure-Hemmstoffs Aminopterin wurde erstmals 1947 von Sidney Farber bei Kindern mit Leukämie genutzt, wodurch eine temporäre Remission (Rückgang, Heilung) der Krebserkrankung erreicht werden konnte.[3][4] In den Jahren zwischen 1953 und 1964 wurde Aminopterin in den Vereinigten Staaten von der Firma Lederle Laboratories, später übernommen von dem Pharmaunternehmen Wyeth, für die Indikationsstellung ‚pädiatrische Leukämie‘ vermarktet. Gleichzeitig wurde von dem Unternehmen schon das strukturähnliche Methotrexat vertrieben. Aufgrund von Schwierigkeiten bei der Herstellung des Stoffs stellte Lederle Laboratories die Produktion von Aminopterin später zugunsten von Methotrexat ganz ein. Neben seiner eigentlichen Anwendung als Zytostatikum, wurde das Mittel in den Vereinigten Staaten im selben Zeitraum an über 4.000 Patienten mit großem Erfolg zur Behandlung von Psoriasis eingesetzt: offensichtlich gingen die Läsionen zurück, ohne dass schwere Nebenwirkungen beobachtet wurden.[5] In den 1950er Jahren wurde Aminopterin als Krebsmedikament durch Methotrexat ersetzt, da letzteres in einem Maus-Tumormodell eine größere therapeutische Breite aufwies.[6] In den 1960ern und davor wurde die Substanz auch als Abortivum (Abtreibungsmittel) erprobt. Nachdem es hierbei jedoch zu kongenitalen Fehlbildungen gekommen war, wurde diese Anwendung nicht weiter verfolgt[7] Vergleichbare fruchtschädigende Wirkungen konnten auch für Methotrexat nachgewiesen werden, so dass die teratogene Effekte von Folsäure-Antagonisten unter dem Begriff (fetales) Aminopterin-Syndrom zusammengefasst werden. Hierbei handelt es sich um ein komplexes Syndrom mit schwerwiegenden Veränderungen des Schädelknochens und Bildung von Klumpfüßen. Betroffene Kinder werden selten lebend geboren und wenn doch überleben sie meist nicht das erste Lebensjahr. Zu solchen schweren Entwicklungsstörungen der frühen Leibesfrucht (Embryopathien) kann es kommen, wenn Folsäure-Hemmstoffe in der 4. bis 12. Schwangerschaftswoche eingenommen werden, wobei das Risiko für eine Schädigung des Embryos für Aminopterin auf 85 % und für Methotrexat auf 50 % geschätzt wird.[8] Obwohl z. B. im Internet häufig behauptet wird, Aminopterin würde auch als Rodentizid (z. B. Rattengift) Verwendung finden, gibt es keinerlei Belege dafür, dass es jemals für einen solchen Zweck auch wirklich eingesetzt wurde.[9] Dagegen spricht zum einen, dass die Herstellung der Substanz komplex und teuer ist. Zum anderen handelt es sich bei Aminopterin um ein in der Umwelt instabiles Molekül, das bei Licht- und Wärmeexposition zerfällt. Wahrscheinlich geht die fälschliche Annahme, bei Aminopterin handele es sich um ein Mittel zur Bekämpfung von Nagetieren, auf ein Patent zurück, das 1951 der American Cyanamid Company (der Mutterfirma der Lederle Laboratories) erteilt wurde und welches vielfach von verschiedenen Fachbüchern und anderen Quellen zitiert wird.[10] Heute wird Aminopterin hauptsächlich bei der Herstellung von monoklonalen Antikörpern zur Selektion von Hybridomzellen im Rahmen der 1975 von César Milstein und Georges Köhler begründeten Hybridom-Technik eingesetzt. PharmakologieAls Folatanalogon blockiert Aminopterin durch kompetitive Hemmung die Dihydrofolatreduktase, ein Enzym, welches Dihydrofolsäure reduziert. Durch die Blockade der Synthese der Tetrahydrofolsäure – sie fungiert im Stoffwechsel aller Lebewesen als wichtiger Methylgruppendonator – kommt es zu einem Mangel an Nukleotidvorläufern, wodurch die für Zellteilungen notwendige Synthese der Desoxyribonukleinsäure (DNA) und der Ribonukleinsäure (RNA) verhindert wird. Dies führt in Folge zu einem Zusammenbruch der Proteinbiosynthese und somit zum Niedergang der betroffenen Zellen und Gewebe. Darüber hinaus wirkt Aminopterin toxisch, weshalb es in der Medizin nicht mehr eingesetzt wird. Die Letale Dosis (LD) für Mäuse, oral als Einzeldosis verabreicht, beträgt 3 mg/kg.[11] FuttermittelskandalAminopterin wurde 2007 vom New York State Food Laboratory in Mengen von mindestens 40 ppm in etwa hundert Hunde- und Katzenfertigfuttermitteln nachgewiesen. Das Labor war mit der Analyse der Proben beauftragt worden, da im Rahmen eines Futtermittelskandals ab Februar 2007 plötzlich schwere Nierenerkrankungen bei Hunden und Katzen beobachtet wurden.[12] Da Methotrexat in höheren Dosen in den Nierenkanälchen auskristallisiert und Nierenschäden verursacht, wurde ein ähnlicher Mechanismus auch für Aminopterin angenommen. Der direkte Zusammenhang zwischen Aminopterin und den futtermittelbedingten Erkrankungen wurde nicht nachgewiesen und gilt als unwahrscheinlich. Stattdessen wurden in den gleichen Futterproben Melamin und Cyanursäure nachgewiesen, die durch Bildung unlöslicher Kristalle in den Nierentubuli die Erkrankungen ausgelöst hatten. Ein Nachweis von Aminopterin bei lebenden Tieren ist nicht möglich. Antioxidantien und Folinsäure können als Therapieversuch eingesetzt werden, ihre Wirkung als Antidot nach lange bestehender Aminopterin-Exposition ist jedoch nicht erwiesen. Weblinks
Einzelnachweise
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||