| 3β-Hydroxysteroid-Dehydrogenase
|
| Masse/Länge Primärstruktur
|
371 / 372 / 369 Aminosäuren
|
| Sekundär- bis Quartärstruktur
|
single-pass Membranprotein (ER, Mit.)
|
| Isoformen
|
NP_000853, NP_000189, NP_079469
|
| Bezeichner
|
| Gen-Name(n)
|
HSD3B1, HSD3B2, HSD3B7
|
| Externe IDs
|
|
| Enzymklassifikationen
|
| EC, Kategorie
|
1.1.1.145, Oxidoreduktase
|
| Reaktionsart
|
Dehydrierung
|
| Substrat
|
Pregnenolon + NAD+
|
| Produkte
|
Pregn-5-en-3,20-dion + NADH/H+
|
| EC, Kategorie
|
5.3.3.1, Isomerase
|
| Reaktionsart
|
Umlagerung
|
| Substrat
|
Pregn-5-en-3,20-dion
|
| Produkte
|
Progesteron
|
| Vorkommen
|
| Übergeordnetes Taxon
|
mehrzellige Tiere, Protozoen[1]
|
3β-Hydroxysteroid-Dehydrogenasen (3β-HSD) sind Enzyme, die in Steroiden die 3β-Hydroxygruppe zum Keton oxidieren und gleichzeitig die Umlagerung der Doppelbindung von der 5- in die 4-Position katalysieren. Diese Reaktion wird in Wirbeltieren bei der Biosynthese von Progesteron aus Pregnenolon benötigt, genauso wie bei der Umwandlung von Dehydroepiandrosteron zu Androstendion oder von 17α-Hydroxypregnenolon zu 17α-Hydroxyprogesteron.
3β-HSD sind Transmembranproteine und lokalisieren zum endoplasmatischen Retikulum und zu den Mitochondrien. Beim Menschen sind drei paraloge Isoformen bekannt, die in unterschiedlichen Gewebetypen exprimiert werden: 3β-HSD I hauptsächlich in den Brustdrüsen, der Plazenta und der Haut; 3β-HSD II vor allem in Nebennieren, Hoden und Eierstöcken. Mutationen im HSD3B2-Gen sind verantwortlich für ein adrenogenitales Syndrom Typ 2 (CAH durch 3-beta-Hydroxysteroid-Dehydrogenase-Mangel).[3][2] Das dritte menschliche Enzym dieser Proteinfamilie ist 3β-HSD Typ 7, ein Enzym der Gallensäurebildung aus Cholesterin.[4]
Katalysierte Reaktionen
 + NAD+ ⇔⇔
+ NAD+ ⇔⇔ 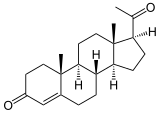 + NADH/H+
+ NADH/H+
Pregnenolon wird zu Progesteron umgesetzt. Es findet nacheinander eine Dehydrierung zum Keton und eine Umlagerung der Doppelbindung statt. Eine weitere Reaktion ist die Umsetzung von DHEA zu Androstendion.[5]
Strukturverweis
Strukturmodell von HSD3B1: siehe vierter Weblink; aus [6]
Weblinks
Einzelnachweise
- ↑ Homologe bei inParanoid
- ↑ a b Welzel M, Wüstemann N, Sîmić-Schleicher G, et al.: Carboxyl-Terminal Mutations in 3β-Hydroxysteroid Dehydrogenase Type II Cause Severe Salt-Wasting Congenital Adrenal Hyperplasia. In: J. Clin. Endocrin. Metabol. 93. Jahrgang, S. 1418–1425.
- ↑ UniProt P26439, UniProt P14060
- ↑ Simard J, Ricketts M-L, Gingras S et al.: Molecular Biology of the 3β-Hydroxysteroid Dehydrogenase/Δ5-Δ4 Isomerase Gene Family. In: Endocrine Rev. 26. Jahrgang, 2005, S. 525–582, doi:10.1210/er.2002-0050, PMID 15632317.
- ↑ Pletnev VZ, Thomas JL, Rhaney FL, et al.: Rational proteomics V: structure-based mutagenesis has revealed key residues responsible for substrate recognition and catalysis by the dehydrogenase and isomerase activities in human 3beta-hydroxysteroid dehydrogenase/isomerase type 1. In: J. Steroid Biochem. Mol. Biol. 101. Jahrgang, Nr. 1, September 2006, S. 50–60, doi:10.1016/j.jsbmb.2006.06.004, PMID 16889958, PMC 1971842 (freier Volltext).
- ↑ Thomas JL, et al.: Structure/Function Relationships Responsible for Coenzyme Specificity and the Isomerase Activity of Human Type 1 3β-Hydroxysteroid Dehydrogenase/Isomerase. In: J.Biol.Chem. 278. Jahrgang, 2003, S. 35483–35490, PMID 12832414 (jbc.org).

