|
| Strukturformel
|
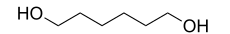
|
| Allgemeines
|
| Name
|
1,6-Hexandiol
|
| Andere Namen
|
- Hexan-1,6-diol
- 1,6-Dihydroxyhexan
- HEXANEDIOL (INCI)[1]
|
| Summenformel
|
C6H14O2
|
| Kurzbeschreibung
|
farblose Kristalle[2][3]
|
| Externe Identifikatoren/Datenbanken
|
|
|
| Eigenschaften
|
| Molare Masse
|
118,18 g·mol−1
|
| Aggregatzustand
|
fest
|
| Dichte
|
0,96 g·cm−3 (20 °C)[2]
|
| Schmelzpunkt
|
45 °C[2]
|
| Siedepunkt
|
250 °C[2]
|
| Dampfdruck
|
< 1 Pa (20 °C)[3]
|
| Löslichkeit
|
sehr gut in Wasser (1000 g·l−1 bei 20 °C)[3]
|
| Sicherheitshinweise
|
|
|
| Toxikologische Daten
|
3730 mg·kg−1 (LD50, Ratte, oral)[2][3]
|
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet.
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa).
|
1,6-Hexandiol ist eine chemische Verbindung aus der Gruppe der Alkandiole. Sie besteht aus dem Grundgerüst des Hexan, an dessen terminalen Positionen sich Hydroxygruppen befinden.
Darstellung
Es existieren mannigfaltige Synthesemöglichkeiten für 1,6-Hexandiol. So kann es durch Reduktion von Adipinsäure mit Lithiumaluminiumhydrid[4] oder deren Ester mit elementarem Natrium[5] erhalten werden.
Auch die Hydrolyse von 1,6-Dibromhexan[6] oder 1,6-Diiodhexan[7] liefern 1,6-Hexandiol. Weitere Möglichkeiten sind die Hydroborierung von 1,5-Hexadien[8] und die reduzierende Ringöffnung von ε-Caprolacton.[9]
Bei der technischen Synthese wird 1,6-Hexandiol meist aus Adipinsäure oder deren Ester durch Reduktion mit molekularem Wasserstoff hergestellt. Hierzu werden in der Regel Temperaturen von 170 bis 240 °C und Drücke von 150 bis 300 bar verwendet.[10] Auch die Hydrierung von ε-Caprolactam oder 6-Hydroxycapronsäure wird zur technischen Synthese eingesetzt.[11]
Eigenschaften
1,6-Hexandiol ist bei Raumtemperatur ein farbloser Feststoff, der bei 45 °C schmilzt.[2] Der Siedepunkt liegt bei Normaldruck bei 250 °C.[2] 1,6-Hexandiol bildet bei höheren Temperaturen entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 147 °C.[2] Der Explosionsbereich liegt zwischen 6,6 Vol.‑% als untere Explosionsgrenze (UEG) und 16 Vol.‑% als obere Explosionsgrenze (OEG).[2] Die Zündtemperatur beträgt 320 °C.[2][12] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
1,6-Hexandiol kann zur Synthese von Oxepan verwendet werden. Hierzu wird es in DMSO bei 190 °C cyclisiert.[13]
1,6-Diaminohexan kann durch die Reaktion mit Ammoniak bei erhöhter Temperatur und hohem Druck erhalten werden.[14]

1,6-Hexandiol wird zur Herstellung von Kunststoffen wie Polyestern oder Polyurethanen eingesetzt. Ferner wird es als Weichmacher und zur Herstellung von Schmiermitteln benötigt.[11]
Einzelnachweise
- ↑ Eintrag zu HEXANEDIOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 3. Juni 2020.
- ↑ a b c d e f g h i j Eintrag zu 1,6-Hexandiol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Oktober 2016. (JavaScript erforderlich)
- ↑ a b c d e f Datenblatt 1,6-Hexandiol bei Merck, abgerufen am 26. Oktober 2021.
- ↑ E. Bernatek: Methylal as a Solvent in Lithium Aluminum Hydride Reductions, in: Acta Chem. Scand., 1954, 8, S. 874–875, doi:10.3891/acta.chem.scand.08-0874, PDF.
- ↑ Budesinsky, Z.; Rockova, E.: Antituberkulöse Stoffe XII. Imidazolid-2-thion-4-carbonsäuren in Collect Czech Chem Commun., 1957, 22, S. 811–813, doi:10.1135/cccc19570811.
- ↑ E. Haworth, W. H. Perkin: Hexamethylene dibromide and its action on sodium and on ethylic sodio-malonate, in: J. Chem. Soc. 1894, 65, S. 591–602; doi:10.1039/CT8946500591.
- ↑ Hamonet, Bull. Soc. Chim. Fr. 1905, 33, S. 530.
- ↑ H. C. Brown, G. Zweifel: The Hydroboration of Dienes, in: J. Am. Chem. Soc., 1959, 81 (21), S. 5832–5833; doi:10.1021/ja01530a071.
- ↑ S. Kim, K. H. Ahn: Ate Complex from Diisobutylaluminum Hydride and n-Butyllithium as a Powerful and Selective Reducing Agent for the Reduction of Selected. Organic Compounds Containing Various Functional Groups, in: J. Org. Chem., 1984, 49, S. 1717–1724; doi:10.1021/jo00184a010.
- ↑ P. Werle, M. Morawietz, S. Lundmark, K. Sörensen, E. Karvinen, J. Lehtonen: Alcohols, Polyhydric, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH, Weinheim, 2008, doi:10.1002/14356007.a01_305.pub2.
- ↑ a b Eintrag zu 1,6-Hexandiol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- ↑ V. J. Traynelis, W. L. Hergenrother, H. T. Hanson, J. A. Valicenti: Dehydration of Alcohols, Diols, and Related Compounds in Dimethyl Sulfoxide, in: J. Org. Chem., 1964, 29 (1), S. 123–129; doi:10.1021/jo01024a028.
- ↑ US-Patent, Eastman Kodak Co., US 2412209, 1943.
|
