|
ورم مخاطي صفاقي كاذب
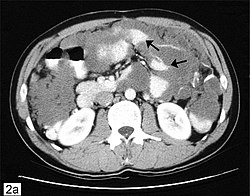
الورم المخاطي الصفاقي الكاذب (بالإنجليزية: Pseudomyxoma peritonei) هي حالة طبية تسببها خلايا سرطانية (سرطان غدي مخاطي) التي تنتج كميات كبيرة من المخاط مسببة استسقاءًا هلاميًا.[2] تتسبب الأورام في تليف الأنسجة مما يعوق عملية الهضم ويؤثر سلبًا علي وظيفة العضو، وإذا تُركت دون علاج فإن الأورام والمخاط الذي تنتجه سوف يملأ التجويف البطني. وسيؤدي ذلك إلى الضغط علي الأعضاء وسيدمر وظيفة القولون أو الأمعاء الدقيقة أو المعدة أو الأعضاء الأخرى. يصبح التكهن بمصير المرض مع العلاج في كثير من الحالات إيجابيًا ولكن المرض مميت إذا لم يُعالج،[3] وقد يكون السبب سوء التغذية وفقر الدم أو انسداد الأمعاء أو أي أنواع أخرى من المضاعفات. يعتبر السرطان الأولي للزائدة (سرطان الزائدة الدودية) أحد أشهر أسباب هذا المرض؛ وقد يصاحب أيضًا أورام المبيض المخاطية، على الرغم من أنه في معظم الحالات يكون مصدر إصابة المبيض نتيجة انتشار ورم خبيث من الزائدة الدودية أو غيرها من الجهاز الهضمي. يصنف المرض عادة على أنه منخفض أو عالي الدرجة. عندما يأتي المرض بخصائص نسيجية منخفضة الدرجة، نادرًا ما ينتشر السرطان عبر الجهاز اللمفاوي أو عبر مجرى الدم. التصنيفهناك جدل كبير بشأن تصنيف الأنسجة المرضية للورم المخاطي الصفاقي الكاذب.[4] في عام 1995، اقترح رونيت تصنيف الحالات إلى فئتين تشخيصيتين:[5] ورم حميد أو ورم خبيث مع فئة ثالثة للحالات ذات السمات الوسطية. في نظام التصنيف هذا، تميزت حالات الورم الحميد بإصابات صفاقيّة مكونة من كميات كبيرة من المخاط خارج الخلية تحتوي على القليل من النسيج الظهاري المخاطي التكاثري مع القليل من السيتولوجية اللانمطية أو النشاط الانقسامي (بدت معظم الخلايا طبيعية إلى حد ما ولم يكن هناك أي دليل على الانقسام الفتيلي الذي يشير إلى أن الخلايا كانت تنقسم بسرعة)، مع أو بدون ورم غدي مخاطي بالزائدة. بينما تتميز حالات الورم الخبيث بإصابات صفاقية تتألف من كميات كبيرة من النسيج الظهاري المخاطي مع السمات الهيكلية والسيتولوجية للسرطان (خلايا غير منتظمة، دليل على أن الخلايا كانت تنقسم بسرعة)، مع أو بدون سرطان غدي مخاطي أولي. جادل برادلي عام 2007 [6] بأن الاستخدام المستمر لمصطلحات غير خبيثة، أي ورم حميد، في وصف تلك الحالات المتكررة ذات السمات منخفضة الدرجة، هو تعبير مضلل لأن الورم الصفاقي المخاطي الكاذب هي حالة مرضية ناتجة عن غزو تجويف البطن بواسطة خلايا ذات نمو غير قابل للتحكم. يوضح برادلي أن الورم الحميد بحكم تعريفه هو ورم محصور في الغشاء المخاطي الزائدي مع عدم وجود أي دليل على انتشاره خارج الغشاء المخاطي العضلي. يستخدم مصطلح سرطان غدي مخاطي في سياقات مختلفة اعتمادًا على المواد المرجعية المستخدمة من قِبل علماء الأمراض لتصنيف المرض. على سبيل المثال، الأورام المتميزة بخصائص الدرجة العالية، والانتشار داخل الغدد والخلايا الحلقية الخماسية، يطلق عليها اسم سرطان غدي في أدبيات علم الأمراض.[7] ولكن يستخدم بعض علماء الأمراض مصطلح سرطان غدي مخاطي عند الإشارة إلى أورام منخفضة الدرجة ذات تميز عالي وتفتقر إلى خصائص عالية الدرجة. يتم استخدام مصطلح سرطان غدي مخاطي منخفض الدرجة من قِبل اللجنة الأمريكية المشتركة المعنية بالسرطان ومنظمة الصحة العالمية.[8] بالنسبة للسرطانات الغدية المخاطية منخفضة الدرجة، يمكن تصنيف المرض على أنه «حميد» لأن الأورام لا تغزو بعمق داخل الأنسجة ونادراً ما تنتشر إلى جزيئات الأعضاء؛ قد يكون هذا التصنيف مضللًا ومربكًا للشخص العادي لأن الورم الصِّفاقي المخاطي الكاذب حالة مميتة إذا لم يُعالج. العلامات والأعراضقد تشمل علامات وأعراض الورم الصفاقي المخاطي الكاذب ألمًا في البطن أو الحوض أو انتفاخ واضطرابات الجهاز الهضمي، وتغييرات الوزن، وزيادة محيط الجسم، والعقم. الأسبابيعزي منشأ الورم الرئيسي إلي الخلايا الكأسية التي تفرز المخاط المتواجدة بكثرة داخل الزائدة. قد تكون الجينات K-Ras و p53 متورطة في عملية تكوين السرطان. في حين ترتبط غالبية هذه الحالات بسرطانات الزائدة،[9] يمكن أيضًا مصاحبتها لحالات أخرى مثل السرطانات الصفاقية، والعديد من الأورام المخاطية (سرطان غدي مخاطي، وسرطان الغدد الصماء المخاطي)..[10] الأماكن الأساسية الأخرى التي قد ينشأ منها الورم تشمل القولون والمستقيم والمعدة والمرارة والقنوات الصفراوية والأمعاء الدقيقة والمثانة البولية والرئة والثدي وقناة فالوب والبنكرياس. التشخيصغالباً ما يتم اكتشاف هذا المرض أثناء الجراحة لحالات أخرى، على سبيل المثال إصلاح الفتق، وبعد ذلك يمكن لأخصائي علم الأمراض ذي الخبرة أن يؤكد التشخيص. قد يكون الورم في مراحل متقدمة حيث يكون محسوسًا داخل البطن أو يسبب انتفاخا للبطن («جيلي البطن» يستخدم أحيانا كمصطلح عام للحالة). بسبب ندرة حدوث هذا المرض، من المهم الحصول على تشخيص دقيق بحيث يمكن الحصول على العلاج المناسب من أخصائي الأورام الجراحي المتخصص في سرطان الزائدة. قد تشمل الاختبارات التشخيصية الأشعة المقطعية، وفحص عينات الأنسجة التي تم الحصول عليها من خلال منظار البطن، وتقييم دلالات الورم. في معظم الحالات، يكون منظار القولون غير مناسب كأداة تشخيص لأنه في معظم الحالات ينتشر سرطان الزائدة داخل التجويف البطني ولكن ليس داخل القولون (ومع ذلك فإن الانتشار داخل القولون تم الإبلاغ عنه في بعض الأحيان). يمكن استخدام تصوير مقطعي بالانبعاث البوزيتروني لتقييم ورم غدي مخاطي عالي الدرجة، ولكن هذا الاختبار لا يمكن الاعتماد عليه للكشف عن الأورام منخفضة الدرجة لأنها لا تمتص الصبغة اللازمة للتصوير. يجري تطوير إجراءات جديدة للتصوير بالرنين المغناطيسي لمتابعة المرض، ولكن لا يتم استخدام التصوير بالرنين المغناطيسي المعياري عادة كأداة تشخيصية. يتم تأكيد التشخيص من خلال الأنسجة. العلاجيتنوع علاج المرض، سواء بسبب ندرته أو بسبب طبيعته بطيئة النمو في كثير من الأحيان. يتراوح العلاج من الانتظار المترقب إلى المعالجة السليمة للجلطات البريتونية (HIPEC). يتضمن مستوى الرعاية للورم الغدي المخاطي عملية جراحية خلوية (CRS) مع العلاج الكيميائي داخل الصفاق (HIPEC) والذي يقوم بها أطباء جراحة الأورام المتخصصين. كما يستخدم بعض الجراحين العلاج الكيميائي البريتوني في مرحلة ما بعد الجراحة (EPIC).[11] الجراحةفي الحالات التي لا تتطلب الجراحة على الفور، يمكن متابعة المرضى عن طريق الأشعة المقطعية،[12] واختبارات دلالات الورم، والأعراض الجسدية لتحديد موعد الجراحة وإذا كانت مضمونة. يحاول الجراح إزالة أكبر قدر ممكن من الورم، تشمل استئصال الغشاء الصفاقي وأي أعضاء مجاورة يشتبه في وجود الورم بها. بما أن المخاط يميل إلى التجمع في قاع التجويف البطني، فمن الشائع إزالة المبيضين وقناتي فالوب والرحم وأجزاء من الأمعاء الغليظة. اعتمادًا على انتشار الورم، قد يتم إزالة الأعضاء الأخرى بما في ذلك على سبيل المثال لا الحصر: المرارة والطحال وأجزاء من الأمعاء الدقيقة والمعدة. بالنسبة للأعضاء التي لا يمكن إزالتها بأمان (مثل الكبد)، يقوم الجراح بإبعاد الورم عن السطح.[13] العلاج الكيميائيالعلاج الكيميائي (عادة ما يكون العامل ميتوميسين C) يمكن حقنه مباشرة في تجويف البطن بعد الجراحة لقتل الأورام السرطانية المجهرية المتبقية والخلايا العائمة الحرة. يوضع العلاج الكيميائي الساخن بالتنقيط في جميع أنحاء التجويف البطني لمدة ساعة أو ساعتين كخطوة أخيرة في الجراحة، أو يتم تثبيت مداخل للسماح بدخول وتصريف المواد الكيميائية لمدة يوم إلى خمسة أيام بعد الجراحة.[14] يمكن إعطاء العلاج الكيميائي الشامل كعلاج إضافي أو مساعد. بسبب زيادة توافر العلاجات الكيميائية الجديدة المطورة لمرضى سرطان القولون والمستقيم، فقد استطاع بعض المرضى تحقيق الاستقرار في نمو الورم مع العلاج الكيميائي الشامل. يتم إعطاء العلاج الكيميائي الشامل للمرضى الذين يعانون من حالة متقدمة أو مرض متكرر أو مرض ينتشر إلى العقد الليمفاوية أو أماكن بعيدة. قد يعاود هذا المرض في الظهور مرة أخري بعد الجراحة والعلاج الكيميائي. تُستخدم فحوصات الأشعة المقطعية الدورية ما بعد الجراحة والفحوص المخبرية لدلالات الورم لتحديد أي نمو جديد لخلايا الورم. معدل الانتشارالمعدل الإجمالي لحدوث المرض هو 0.5 إلى 1 حالة لكل 100.000 شخص في السنة.[15] وهو أكثر شيوعًا في النساء أكثر من الرجال (نسبة الذكور إلى الإناث = 9:11). يبلغ متوسط العمر عند ظهور المرض عادةً حوالي 50 عامًا مع نطاق يتراوح بين 20 و25 عامًا. المراجع
وصلات خارجية |
||||||||||||||