|
Interaksi agostikInteraksi agostik merupakan istilah dalam kimia organologam yang digunakan untuk merujuk pada interaksi antara logam transisi dengan ikatan karbon-hidrogen, dengan dua elektron yang terlibat pada ikatan C-H memasuki orbital d logam transisi yang kosong, menghasilkan ikatan tiga-pusat dua-elektron.[1] Banyak transformasi katalitik seperti adisi oksidatif dan eliminasi reduktif yang diajukan berjalan melalui zat antara yang memiliki interaksi agostik. Interaksi agostik terpantau pada kimia organik yang melibatkan ligan alkil, alkilidena, dan polienil. SejarahIstilah agostik diciptakan oleh Maurice Brookhart dan Malcolm Green untuk mendeskripsikan interaksi antara logam transisi dengan ikatan karbon-hidrogen. Sering kali, interaksi agostik seperti ini melibatkan gugus alkil ataupun aril yang berada dekat dengan pusat logam melalui ikatan sigma tambahan.[2][3] Interaksi pendek antara substituen hidrokarbon dengan kompleks logam yang secara koordinatif tak jenuh telah tercatat sejak tahun 1960-an. Sebagai contohnya, tris(trifenilfosfina) rutenium diklorida memiliki interaksi yang terpantau antara pusat Ru(II) dengan atom hidrogen pada posisi orto salah satu dari sembilan cincin fenil.[4] 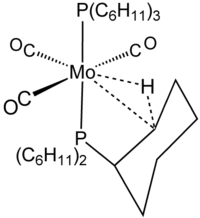 Karakteristik ikatan agostikInteraksi agostik dapat diperlihatkan dengan baik oleh kristalografi. Data difraksi neutron menunjukkan bahwa panjang ikat C-H dan M-H 5-20% lebih panjang daripada yang terdapat pada ikatan logam hidrida dan hidrokarbon biasanya. Panjang ikat antara logam dengan hidrogen umumnya adalah 1,8 - 2,3 Ǻ, dan sudut M-H-C berkisar antara 90 - 140°. Terdapat pula satu signal 1H NMR dari hidrogen aril atau alkana yang bergeser ke medan atas yang biasanya menandakan keberadaan ligan hidrida. Konstanta kopling 1JCH biasanya akan menurun menjadi 70–100 Hz dibandingkan dengan 125 Hz yang terpantau pada ikatan karbon hidrogen sp3 yang biasanya. Kekuatan ikatanBerdasarkan kajian eksperimental dan komputasional, stabilisasi yang dihasilkan dari interaksi agostik diperkirakan berkisar antara 10–15 kcal/mol. Oleh karena itu, interaksi agostik lebih kuat dari kebanyakan ikatan hidrogen. Ikatan agostik kadang-kadang berperan penting dalam katalisis dengan meningkatkan 'kekakuan' keadaan transisi. Sebagai contoh, pada katalisis Ziegler-Natta, pusat logam yang sangat elektrofilik memiliki interaksi agostik dengan rantai polimer yang memanjang. Peningkatan kekakuan ini memengaruhi stereoselektivitas proses polimerisasi. Interaksi ikatan yang berkaitanIstilah agostik biasanya hanya digunakan untuk merujuk pada interaksi tiga pusat dua elektron antara karbon, hidrogen, dan logam. Ikatan tiga-pusat dua-elektron secara jelas terlibat dalam kompleksasi H2, misalnya dalam in W(CO)3(PCy3)2H2, yang berhubungan dekat dengan kompleks agostik yang terdapat pada gambar di atas.[5] Silana sering berikatan dengan pusat logam melalui interaksi tiga pusat Si-H-M yang seperti interaksi agostik. Namun interaksi ini tidak diklasifikasikan sebagai agostik karena tidak melibatkan atom karbon. Ikatan anagostikInteraksi M---H-C tertentu tidak diklasifikasikan sebagai "agostik", tetapi diklasifikasikan sebagai "anagostik". Interaksi anagostik memiliki sifat-sifat yang lebih elektrostatik. Dalam hal strukturnya, jarak M---H dan sudut M-H-C berkisar antara 2,3-2,9 Ǻ dan 110-170° secara berturut-turut.[2][6] Referensi
Pranala luar
|