|
Ikatan pisang Ikatan pisang adalah istilah dalam kimia organik yang merujuk pada sejenis ikatan kimia kovalen yang geometri ikatannya melengkung menyerupai pisang. Molekul siklik kecilIkatan pisang [1][2][3] adalah sejenis ikatan kimia khusus yang mana keadaan hibridisasi dua atom yang berikatan berubah, dengan karakter orbital s orbital tersebut meningkat ataupun menurun untuk menyesuaikan diri dengan geometri molekul yang terbatas. Ikatan pisang dapat ditemukan pada senyawa organik seperti siklopropana, oksiran, dan aziridina. Pada senyawa-senyawa tersebut, adalah tidak mungkin atom karbon memiliki sudut ikat 109,5° seperti yang terdapat pada hibridisasi sp³ biasanya. Peningkatan karakter p membuat atom karbon ini dapat mengurangi sudut ikat menjadi 60°. Pada saat yang sama pula, ikatan karbon ke hidrogen menerima karakter s yang lebih besar dan akan memendek. Pada siklopropana, rapatan elektron maksimum antara dua atom karbon tidaklah sejajar dengan sumbu ikat kedua atom tersebut, melainkan melengkung. Pada siklopropana, sudut antarorbital-nya adalah 104°. Pelengkungan ini dapat dipantau secara eksperimen menggunakan difraksi sinar-X beberapa turuna siklopropana. Pada siklopropana, terpantau bahwa panjang ikat antar karbon lebih pendek (151 pm) dari yang biasanya (154 pm). Siklobutana memiliki cincin yang lebih besar, namun ikatannya masih melengkung. Pada molekul ini, sudut ikat karbon adalah 96° untuk konformasi planar, dan 88° untuk konformasi lipatan. Berbeda dengan siklopropana, panjang ikat antar karbon pada siklobutana meningkat. Hal ini dikarenakan tolakan sterik 1,3-nonikatan. Reaktivitas siklobutana relatif inert dibandingkan siklopropana, dan berperilaku seperti alkana biasanya. Ikatan rangkap dua dan rangkap tiga 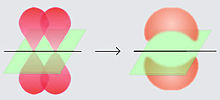 Terdapat dua penjelasan berbeda yang diajukan untuk menjelaskan sifat-sifat ikatan kovalen rangkap dua dan rangkap tiga dalam molekul organik pada tahun 1930-an. Linus Pauling mengajukan bahwa ikatan rangkap dua merupakan akibat dari dua ikatan yang setara.[4] Model ikatan ini kemudian disebut ikatan pisang. Sengkan Erich Hückel mengajukan bahwa ikatan rangkap dua merupakan kombinasi antara ikatan sigma dengan ikatan pi.[5] Model Hückel merupakan yang paling dikenal dan dapat ditemukan pada kebanyakan buku-buku teks kimia akhir abad ke-20. Terdapat perdebatan mengenai representasi siapakah yang paling tepat,[6] walaupun kimiawan teoretis menganggap kedua model tersebut memiliki kedudukan yang setara. Pada tinjauan tahun 1996, Kenneth B. Wiberg menyimpulkan bahwa "walaupun pernyataan yang konklusif tidak dapat dibuat berdasarkan informasi yang ada sekarang ini, tampaknya kita dapat terus memperlakukan deskripsi σ/π dan ikatan pisang etilena sebagai dua penjelasan yang setara."[2] Penerapan lainnyaTeori ikatan pisang juga dapat menjelaskan fenomena-fenomena lainnya dalam molekul organik. Fluorometana (CH3F) contohnya memiliki sudut ikat eksperimental sebagai 109°, walaupun seharusnya ia lebih kecil. Hal ini dikarenakan menurut kaidah Bent, ikatan C-F mendapatkan karakter orbital p yang menyebabkan ikatan C-H berkarakter s lebih banyak, sehingga sudut ikat H-C-H akan lebih menyerupai orbital sp2 dan mengakibatkan sudut ikat F-C-H lebih kecil. Perbedaan ini dapat dijelaskan menggunakan teori ikatan pisang.[2] Referensi
Pranala luar
|