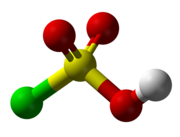
氯磺酸(化学式:HSO3Cl)是一种无色或淡黄色的液体,為劇毒。具有辛辣气味,在空气中发烟,是硫酸的一个-OH 基团被氯取代后形成的化合物。分子为四面体构型,取代的基团处于硫酸与硫酰氯之间,有催泪性,主要用于有机化合物的磺化,制取药物、染料、农药、洗涤剂等。
制取
工业上用三氧化硫和氯化氢发生化合反应制得氯磺酸:
- HCl + SO3 → HSO3Cl
干燥的氯化氢气体通入发烟硫酸,或五氯化磷与浓硫酸反应都可以得到氯磺酸,多用于实验室中:
- PCl5 + SO2(OH)2 → HSO3Cl + POCl3 + HCl
反应
與單質的反應
氯磺酸与碳反应得到二氧化碳、二氧化硫和氯化氢。
与锡反应得到四氯化锡:
Sn+4HSO3Cl→SnCl4+2H2SO4+2SO2
与磷反应得到磷酸。
与锑、砷反应得到对应的三氯化物
与一些硫属元素或碘反应得到多聚阳离子
硒溶于室温下的氯磺酸,得到深绿色溶液:
8Se+4HSO3Cl→Se82+(深绿色)+2ClSO3-+H2SO4 + 2HCl+SO2
硒溶于热的氯磺酸,得到黄色溶液:
4Se+4HSO3Cl(热)→Se42+(黄色)+2ClSO3-+H2SO4 + 2HCl+SO2
碲溶于氯磺酸得到红色溶液:
4Te+4HSO3Cl→Te42+ (红色)+2ClSO3-+H2SO4 + 2HCl+SO2
碘在室温下缓慢地溶于氯磺酸,得到红棕色的溶液:
5I2+4HSO3Cl→2I5+ (红棕色)+2ClSO3-+H2SO4 + 2HCl+SO2
氯磺酸与硫反应的产物比较复杂,除了产生二氯化硫和二氧化硫之外,还会根据反应条件的差异而得到两种不同的多硫阳离子S192+(红色)和S42+(黄色)
与氧化物的反应
氯磺酸遇水发生剧烈水解并发出爆鸣声,生成硫酸和盐酸:
- HSO3Cl + H2O → H2SO4 + HCl
与过氧化氢反应得到过一硫酸和过二硫酸:
- HSO3Cl + H2O2 → H2SO5 + HCl
- 2HSO3Cl + H2O2 → H2S2O8 + 2HCl
与氮氧化物反应得到硝基阳离子或亚硝基阳离子:
- 与三氧化二氮反应:
- N2O3 + 3HSO3Cl →2NO+ + 2ClSO3- + H2SO4 + HCl
- 与四氧化二氮的反应:
- N2O4 + 3HSO3Cl →NO2+ + NO+ + 2ClSO3- + H2SO4 + HCl
- 与五氧化二氮的反应:
- N2O5 + 3HSO3Cl →2NO2+ + 2ClSO3- + H2SO4 + HCl
与砷、锑、铋的氧化物反应得到对应的MOSO3Cl (Oxychlorosulfonate):
- M2O3 + 3HSO3Cl →2MOSO3Cl + H2SO4 + HCl
- (M=As,Sb,Bi)
此外,五氧化二钒、二氧化铈、二氧化钍和三氧化二镧与氯磺酸反应分别得到弱电解质H[VO(SO3Cl)4],Ce(SO3Cl)4,H2[Th(SO3Cl)6],H[La(SO3Cl)4][1]
与有机物的反应
氯磺酸可用于制备磺酰氯。
Ar-H + 2HSO3Cl → Ar-SO2Cl+HCl+H2SO4
参见
参考资料
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001, pages 549-550 (discussion of XSO2OH for X = F, Cl, Br, I)
- R.J. Cremlyn, "Chlorosulfonic Acid" Springer-Verlag New York, Inc. (Royal Society of Chemistry, 2002, 300 pp. ISBN 978-0-85404-498-6