|
Pericyklisk reaktion
 Pericykliska reaktioner är reaktioner där elektronerna flyttar sig i en sluten ring, utan intermediärer, joner eller fria radikaler – det sägs att mekanismen är konserterad. Reaktionerna är många gånger utpräglade jämviktsreaktioner, även om reaktionen kan drivas i ena riktningen. Pericykliska reaktioner står i kontrast till linjära reaktioner, som omfattar de flesta organiska omvandlingar och fortgår genom ett acykliskt övergångstillstånd, å ena sidan, och koarktatreaktioner, som fortsätter genom ett dubbelcykliskt, samordnat övergångstillstånd å andra sidan. Pericykliska reaktioner är vanligtvis omlagring eller additionsreaktioner. De viktigaste klasserna av pericykliska reaktioner anges i tabellen nedan (de tre viktigaste klasserna visas i fetstil). Ene-reaktioner och keletropa reaktioner klassas ofta som gruppöverföringsreaktioner respektive cykloadditioner/cykloelimineringar, medan dyotropa reaktioner och gruppöverföringsreaktioner (om ene-reaktioner är uteslutna) sällan påträffas.
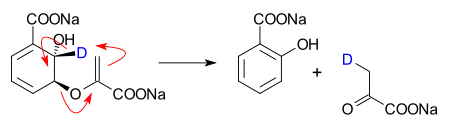
I allmänhet anses dessa vara jämviktsprocesser, även om det är möjligt att driva reaktionen i en riktning genom att utforma en reaktion där produkten har en betydligt lägre energinivå. Detta beror på en unimolekylär tolkning av Le Chateliers princip. Det finns alltså en uppsättning "retro"-pericykliska reaktioner. Mekanism för pericyklisk reaktionPer definition fortskrider pericykliska reaktioner genom en samordnad mekanism som omfattar ett enda cykliskt övergångstillstånd. På grund av detta, innan en systematisk förståelse av pericykliska processer genom principen om bevarande av orbitalsymmetri, kallades de facettiska som "ingen mekanism-reaktioner". Emellertid har reaktioner, för vilka pericykliska mekanismer kan dras, ofta relaterade stegvisa mekanismer som fortskrider genom radikala eller dipolära mellanprodukter som också är livskraftiga. Vissa klasser av pericykliska reaktioner, såsom [2+2] ketencykloadditionsreaktioner, kan vara "kontroversiella" eftersom deras mekanism ibland inte är definitivt känd för att vara samordnad (eller kan bero på det reaktiva systemet). Dessutom har pericykliska reaktioner också ofta metallkatalyserade analoger, även om dessa vanligtvis inte heller är tekniskt pericykliska, eftersom de går via metallstabiliserade mellanprodukter och därför inte är samordnade. Trots dessa varningar är den teoretiska förståelsen av pericykliska reaktioner förmodligen bland de mest sofistikerade och välutvecklade inom all organisk kemi. Förståelsen av hur orbitaler interagerar under loppet av en pericyklisk process har lett till Woodward-Hoffmann-reglerna, en enkel uppsättning kriterier för att förutsäga om en pericyklisk mekanism för en reaktion är sannolik eller gynnsam. Till exempel förutspår dessa regler att [4+2] cykloaddition av butadien och eten under termiska förhållanden sannolikt är en pericyklisk process, medan [2+2] cykloaddition av två etenmolekyler inte är det. Dessa överensstämmer med experimentella data, som stöder ett ordnat, samordnat övergångstillstånd för det förra och en radikal process i flera steg för det senare. Flera likvärdiga tillvägagångssätt, som beskrivs nedan, leder till samma förutsägelser. Aromatiska övergångstillståndsteorin antar att det minsta energiövergångstillståndet för en pericyklisk process är aromatiskt, med valet av reaktionstopologi bestämt av antalet involverade elektroner. För reaktioner som involverar (4 n + 2)-elektronsystem (2, 6, 10, ... elektroner; udda antal elektronpar) föreslås Hückel- topologiövergångstillstånd, där den reaktiva delen av den eller de reagerande molekylerna har orbitaler som interagerar i en kontinuerlig cykel med ett jämnt antal noder. I 4 n -elektronsystem (4, 8, 12, ... elektroner; jämnt antal elektronpar) föreslås Möbiustopologiövergångstillstånd, där de reagerande molekylerna har orbitaler som interagerar i en vriden kontinuerlig cykel med ett udda antal noder. Motsvarande (4 n + 2)-elektron Möbius- och 4 n -elektron Hückel-övergångstillstånd är antiaromatiska och är därför starkt ogynnsamma. Aromatisk övergångstillståndsteori resulterar i ett särskilt enkelt uttalande av de generaliserade Woodward–Hoffmann-reglerna: En pericyklisk reaktion som omfattar ett udda antal elektronpar kommer att fortgå genom ett Hückel-övergångstillstånd (jämnt antal antarafaciala komponenter i Woodward–Hoffmanns terminologi),[1] medan en pericyklisk reaktion som omfattar ett jämnt antal elektronpar kommer att fortsätta genom ett Möbius-övergångstillstånd (udda antal antarafaciala komponenter). På motsvarande sätt har pericykliska reaktioner analyserats med korrelationsdiagram, som spårar utvecklingen av de molekylära orbitalerna (känd som "korrelera" de molekylära orbitalerna) hos de reagerande molekylerna när de utvecklas från reaktanter till produkter via ett övergångstillstånd, baserat på deras symmetriegenskaper. Reaktioner är gynnsamma ('tillåtna') om reaktanternas grundtillstånd korrelerar med produkternas grundtillstånd, medan de är ogynnsamma ('förbjudna') om reaktanternas grundtillstånd korrelerar med produkternas exciterade tillstånd. Denna idé är känd som bevarandet av orbitalsymmetri. Övervägande av växelverkan mellan de högst ockuperade och lägsta lediga molekylära orbitalen (gränsorbitalanalys) är ett annat tillvägagångssätt för att analysera övergångstillståndet för en pericyklisk reaktion. Piltryckning för pericykliska reaktionerDen piltryckande konventionen för pericykliska reaktioner har en något annan innebörd jämfört med polära (och radikala) reaktioner. För pericykliska reaktioner finns det ofta ingen uppenbar rörelse av elektroner från en elektronrik källa till en elektronfattig sänka. Snarare omfördelas elektroner runt ett cykliskt övergångstillstånd. Således kan elektroner skjutas i någon av två riktningar för en pericyklisk reaktion. För vissa pericykliska reaktioner finns det emellertid en bestämd polarisering av laddningen vid övergångstillståndet på grund av asynkronicitet (bindningsbildning och brott sker inte i en enhetlig utsträckning vid övergångstillståndet). Således kan en riktning vara att föredra framför en annan, även om båda skildringarna fortfarande är formellt korrekta. När det gäller Diels-Alder-reaktionen som visas nedan, klargör resonansargument polarisationens riktning. 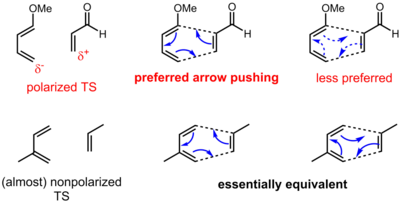
Pseudopericykliska bearbetareNära besläktade med pericykliska processer är reaktioner som är pseudopericykliska. Även om en pseudopericyklisk reaktion fortskrider genom ett cykliskt övergångstillstånd, är två av de involverade orbitalerna begränsade till att vara ortogonala och kan inte interagera, vilket kanske är det mest kända exemplet. Även om detta verkar vara en 4-elektron Hückel-topologi förbjuden gruppöverföringsprocess, är den tomma p-orbitalen och SP2-hybridiserade BH-bindningen ortogonala och interagerar inte. Woodward-Hoffmann-reglerna gäller därför inte. (Det faktum att hydroboration tros fortsätta genom initial π-komplexbildning kan också vara relevant.) I biokemiPericykliska reaktioner förekommer också i flera biologiska processer:
Se även
Referenser
Noter
Externa länkar
|
|||||||||||||||||||||||||||||||