|
LaktonEn lakton är en cyklisk karboxyllisk ester, som innehåller en 1-oxacykloalkan-2-on-struktur (-C(=O)-O-), eller analoger med omättnad eller heteroatomer som ersätter en eller flera kolatomer i ringen.[1] Laktoner bildas genom intramolekylär förestring av motsvarande hydroxikarboxylsyror, vilket sker spontant när ringen som bildas är fem- eller sexledad. Laktoner med tre- eller fyrledade ringar (α-laktoner och β-laktoner) är mycket reaktiva, vilket gör deras isolering svår. Särskilda metoder krävs normalt för laboratoriesyntes av laktoner med små ringar samt sådana som innehåller ringar som är större än sexledade.[2] Nomenklatur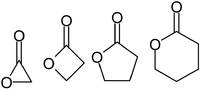 Grekiska prefix i alfabetisk ordning anger ringstorlek.
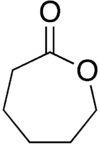
Laktoner benämns vanligtvis enligt prekursorsyramolekylen (aceto = 2 kolatomer, propio = 3, butyro = 4, valero = 5, capro = 6, etc.), med ett -laktonsuffix och en grekisk bokstavsprefix som specificerar antal kolatomer i heterocykeln - det vill säga avståndet mellan de relevanta -OH- och -COOH-grupperna längs nämnda ryggrad. Den första kolatomen efter kolet i -COOH-gruppen på moderföreningen är märkt α, den andra kommer att märkas β, och så vidare. Därför anger prefixen även laktonringens storlek: α-lakton = 3-ledad ring, β-lakton = 4-ledad, γ-lakton = 5-ledad, δ-lakton = 6-ledad, etc. Makrocykliska laktoner är kända som makrolaktoner.[3] Det andra suffixet som används för att beteckna en lakton är -olid, som används i ämnesklassnamn som butenolid, makrolid, kardenolide eller bufadienolide. För att erhålla de föredragna IUPAC-namnen, namnges laktoner som heterocykliska pseudoketoner genom att lägga till suffixet "on", "dion", "thion", etc. och lämpliga multiplikativa prefix till namnet på den heterocykliska moderhydriden.[4] Naturliga källorNaturligt förekommande laktoner är huvudsakligen mättade och omättade γ- och δ-laktoner, och i mindre utsträckning makrocykliska laktoner. γ- och δ-laktonerna är intramolekylära estrar av motsvarande hydroxifettsyror. De bidrar till aromen av frukt, smör, ost och andra livsmedel. Cyklopentadekanolid är orsak till den myskaktiga lukten av kvanne. Av de naturligt förekommande bicykliska laktonerna är ftalider orsak till lukten av selleri och libbsticka, och kumarin för myskmadra.[5] Laktoner finns i ekträ och de bidrar till smakprofilen hos fatlagrad öl.[6] Laktonringar förekommer allmänt som byggstenar i naturen, som i askorbinsyra, kavain, nepetalakton, glukonolakton, hormoner (spironolakton, mevalonolakton), enzymer (laktonas), signalsubstanser(butyrolakton, avermectiner), antibiotika (makrolider som erytromycin B), läkemedel mot cancer (vernolepin, epotiloner), fytoöstrogener (resorcylsyralaktoner, hjärtglykosider). Synteser Många metoder för estersyntes kan också tillämpas på laktoner. I en industriell syntes av oxandrolon är det viktigaste laktonbildande steget en organisk reaktion - förestring.[7][8]  Vid halolaktonisering angrips en alken av en halogen via elektrofil tillsats med den katjoniska intermediären fångad intramolekylärt av en intilliggande karboxylsyra.[9] Specifika metoder inkluderar Yamaguchi-förestring, Shiina-makrolaktonisering, Corey-Nicolaou-makrolaktonisering, Baeyer-Villiger-oxidation och nukleofil abstraktion.  γ-laktonerna γ-oktalakton, γ-nonalakton, γ-dekalakton, γ-undekalakton kan framställas med gott utbyte i en enstegsprocess genom radikal tillsats av primära fettalkoholer till akrylsyra, med användning av di-tert-butylperoxid som katalysator.[5] En alternativ radikalreaktion som ger γ-laktoner är den manganmedierade kopplingen. ReaktionerDen mest stabila strukturen för laktoner är 5-ledade γ-laktoner och 6-ledade δ-laktoner eftersom, som i alla organiska cykler, 5- och 6-ledade ringar minimerar töjningen av bindningsvinklar. γ-laktoner är så stabila att, i närvaro av utspädda syror vid rumstemperatur, 4-hydroxisyror (R-CH(OH)-(CH2)2-COOH) omedelbart genomgår spontan förestring och cyklisering till laktonen. β-laktoner finns, men kan endast tillverkas med speciella metoder. α-laktoner kan påvisas som övergående arter i masspektrometriexperiment.[10] Reaktionerna för laktoner liknar reaktionerna för estrar, som exemplifieras av gamma-lakton i följande avsnitt: HydrolysUpphettning av en lakton med en bas (natriumhydroxid) kommer att hydrolysera laktonen till dess moderförening, den rakkedjiga bifunktionella föreningen. Liksom rakkedjiga estrar är hydrolys-kondensationsreaktionen av laktoner en reversibel reaktion, med en jämvikt. Emellertid är jämviktskonstanten för hydrolysreaktionen av laktonen lägre än den för den rakkedjiga estern, det vill säga produkterna (hydroxisyrorna) är mindre gynnade i fallet med laktonerna. Detta beror på att även om entalpierna för hydrolysen av estrar och laktoner är ungefär desamma, är entropin för hydrolysen av laktoner mindre än entropin för rakkedjiga estrar. Rakkedjade estrar ger två produkter vid hydrolys, vilket gör entropiförändringen mer gynnsam än i fallet med laktoner som endast ger en enda produkt. ReduceringLaktoner kan reduceras till dioler med litiumaluminiumhydrid i torr eter. Reduktionsreaktionen kommer först att bryta esterbindningen av laktonen och sedan reducera aldehydgruppen (-CHO) till alkoholgruppen (-OH). Till exempel kommer gamma-laktoner att reduceras till butan-1, 4-diol, (CH2(OH)-(CH2)2-CH2(OH). AminolysLaktoner reagerar också med etanolisk ammoniak, som först bryter esterbindningen och sedan reagerar med den sura -COOH-gruppen, på grund av ammoniakens grundläggande egenskaper, för att bilda en difunktionell grupp, det vill säga alkohol och amid. Gamma-laktoner kommer att reagera för att ge CH2(OH)-(CH2)2-CO-NH2. PolimerisationLaktoner bildar lätt polyestrar enligt formeln och har också visat sig oligomerisera utan katalysator:[11][12] MichaelreaktionSesquiterpenlaktoner, som finns i många växter, kan reagera med andra molekyler via en Michael-reaktion. Exempel
Se ävenReferenser
Noter
Externa länkar
|