|
Disulfidbindning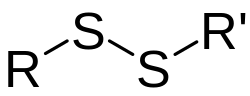 En disulfidbindning eller svavelbrygga är en kemisk bindning mellan två tiolers funktionella sidogrupp. 2 R-SH ↔ R-S-S-R' AllmäntDå två sulfhydrylgrupper, -SH, oxideras bildas en kovalent bindning som kallas disulfidbindning. Inom kemin betecknas denna ofta -S-S-. Kovalenta bindningar är starka bindningar, vilket gör att det krävs mycket energi för att bryta upp bindningen. Faktorer som påverkar ifall en disulfidbindning kan uppstå eller inte:
 VätedisulfidFöreningen vätedisulfid är två väteatomer med en disulfidbindning mellan sig. Avståndet mellan svavelatomerna är i vätedisulfid 2,06 Å. ProteinerDisulfidbindningar är vanliga inom proteiner och är då mycket viktiga för proteinets tredimensionella (sekundära eller tertiära) struktur.[2] Ju fler disulfidbindningar som finns i ett protein desto starkare är den tredimensionella strukturen. CystinAminosyran cystein har en tiolgrupp. Från att cysteinerna är i sin -SH-form kommer två cysteiner att tappa sina väteatomer och slå ihop sig så att en -S-S- bindning bildas. I reaktionen har väteatomen från det ena cysteinets sulfhydrylgrupp släppt och sidogruppen har nu blivit till en, S-, anjon (negativ). Anjonen kan då göra en nukleofil attack mot den andra cysteinmolekylens sidogrupp, och bildar då en disulfidbindning.[1] I denna reaktion frisläpps elektroner och totalt två vätejoner. Genom att tillsätta reduktionsmedel går det att bryta disulfidbindningen så att det blir två fria cysteiner igen. När två cysteinmolekyler bildar en disulfidbindning mellan sig kallas produkten cystin. Referenser |