|
Эритропоэз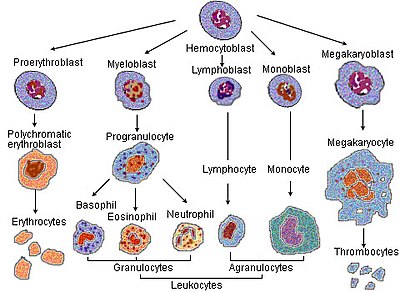 Эритропоэ́з (от др.-греч. ἐρυθρός — ‛красный’, и ποίησις — ‛производство’) — это одна из разновидностей процесса гемопоэза (кроветворения), в ходе которой образуются красные кровяные клетки (эритроциты). Эритропоэз стимулируется уменьшением доставки кислорода к тканям, которое детектируется почками. Почки в ответ на тканевую гипоксию или ишемию выделяют гормон эритропоэтин, который стимулирует эритропоэз[2]. Этот гормон стимулирует пролиферацию и дифференциацию клеток-предшественников красного кровяного ростка, приводя тем самым к ускоренному эритропоэзу в кроветворных тканях и к увеличению выхода эритроцитов в кровь[2]. У птиц и млекопитающих (включая человека) после рождения гемопоэз — и в том числе эритропоэз — осуществляется в костном мозге, который и является единственной кроветворной тканью в норме после рождения[2]. У ранних эмбрионов и плодов гемопоэз происходит в мезодермальных клетках желточного мешка. Начиная с третьего месяца беременности, у человека гемопоэз (и в частности эритропоэз) начинает происходить в фетальной печени и фетальной селезёнке[3]. После 7-го месяца беременности гемопоэз у плода происходит преимущественно в костном мозге. Повышение физической активности (то есть повышение потребности тканей в кислороде), а также кровопотеря, курение (то есть пониженная доставка кислорода тканям из-за хронического воздействия угарного газа), пребывание в горах (то есть в местности с пониженным парциальным давлением кислорода), некоторые сердечно-сосудистые заболевания (например, сердечная недостаточность) и лёгочные заболевания (например, хроническая бронхообструктивная болезнь), приводящие к нарушению доставки кислорода тканям, могут способствовать усилению эритропоэза. Напротив, при почечной недостаточности с нарушением выработки эритропоэтина, при дефиците белков, витамина B12 или фолиевой кислоты, железа и других нутриентов, при хронических инфекциях, при злокачественных опухолях, при ряде интоксикаций, при ряде заболеваний костного мозга (например, таких, как миелодиспластический синдром или лейкоз) — наблюдается нарушение или угнетение эритропоэза, приводящее к снижению уровня гемоглобина и эритроцитов — к развитию анемии[4]. У людей с некоторыми заболеваниями и у некоторых видов животных при некоторых обстоятельствах гемопоэз, и в том числе эритропоэз, может также происходить и вне пределов костного мозга, в печени и/или селезёнке. Это называется «экстрамедуллярный (внекостномозговой) гемопоэз». Костный мозг практически всех костей тела человека участвует в выработке клеток крови (гемопоэзе) приблизительно до 5 лет. Кости бёдер и голеней прекращают вносить существенный вклад в гемопоэз приблизительно к 25 годам. Костный мозг, расположенный в костях позвонков, грудины, таза и рёбер, а также кости черепа продолжают вносить вклад в гемопоэз в течение всей жизни человека. Дифференциация эритроцитовВ процессе созревания эритроцитов клетка кровяного ростка в костном мозгу проходит несколько последовательных стадий деления и созревания (дифференциации), а именно:
После завершения 8-й стадии получившиеся клетки — то есть ретикулоциты — выходят из костного мозга в общее кровеносное русло. Таким образом, среди циркулирующих красных кровяных клеток около 1 % составляют ретикулоциты. После 1—2 дней пребывания в системном кровотоке ретикулоциты заканчивают созревание и становятся, наконец, зрелыми эритроцитами. Все эти стадии развития сопровождаются соответствующими морфологическими изменениями внешнего вида клетки при окраске по Райту и рассмотрении в световой микроскоп, а также определёнными биохимическими и иммунофенотипическими изменениями. В частности, в процессе созревания базофильный пронормобласт, крупная клетка с огромным ядром, имеющая объём в среднем 900 фемтолитров, превращается в безъядерный диск объёмом в 10 раз меньше — в среднем приблизительно 95 фемтолитров. На стадии ретикулоцита клетка уже избавилась от ядра, но всё ещё способна накапливать и производить дополнительный гемоглобин, поскольку имеет «оборудование» для производства белка — рибосомы. Зрелые же эритроциты лишены не только ядра, но и рибосом, и поэтому нового гемоглобина не накапливают, а лишь транспортируют и используют уже имеющийся в течение отведённого им срока жизни. По этой же причине зрелые эритроциты, в отличие от ретикулоцитов, лишены поверхностных рецепторов к трансферрину (то есть не способны более захватывать и усваивать дополнительное железо). Критически необходимым для созревания красных кровяных клеток (эритроцитов) является достаточное поступление витамина B12 (кобаламина) и фолиевой кислоты, а также витамина B6 (пиридоксина) и витамина B2 (рибофлавина), особенно первых двух. Дефицит любого из них вызывает нарушение процессов созревания эритроцитов, что клинически проявляется анемией (снижением содержания в крови эритроцитов и гемоглобина), макроцитозом (аномально крупными размерами эритроцитов), мегалобластозом костного мозга или, иначе говоря, мегалобластным типом кроветворения (аномально крупными размерами проэритробластов и эритробластов, называемых в этом случае соответственно промегалобластами и мегалобластами) и ретикулоцитопенией (аномально низким количеством ретикулоцитов в крови). При этом каждый отдельный эритроцит не только крупнее обычного, но и — компенсаторно — обычно содержит гемоглобина больше, чем в норме. Цветной показатель крови при этом может быть больше единицы («гиперхромная анемия») или нормален («нормохромная анемия»), но самих эритроцитов образуется меньше, чем нужно, поскольку витамин B12 и фолиевая кислота критически необходимы для деления клеток-предшественников эритроцитарного ростка. Это называется мегалобластной анемией. Для синтеза гемоглобина клеткам-предшественникам эритроцитов необходимо железо. Дефицит железа вызывает снижение как общего содержания гемоглобина в крови, так и его содержания в каждом отдельном эритроците (то есть, в противоположность предыдущему случаю, гемоглобина в каждом отдельном эритроците не больше, а меньше нормы), а также может вызывать уменьшение размеров эритроцитов («микроцитоз», «микроцитарная анемия»). Либо же размеры эритроцитов не изменяются, но количество гемоглобина в них ниже нормы («нормоцитарная» гипохромная анемия, то есть с обычных размеров, но более бледными эритроцитами). Может также наблюдаться некоторое (меньшее, чем при дефиците витамина B12 или фолиевой кислоты) уменьшение количества эритроцитов. Цветной показатель крови при этом либо нормален и не изменён («нормохромная анемия»), либо снижен («гипохромная анемия»). И опять-таки отмечается аномально низкое количество ретикулоцитов в крови — ретикулоцитопения. После кровопотери или при гипоксии (например, при подъёме в горы или переезде в горную местность или развитии лёгочного либо сердечно-сосудистого заболевания с гипоксией), или при стимулировании эритроцитарного ростка костного мозга экзогенно введённым эритропоэтином, или в фазе восстановления после химиотерапии, или при назначении больному с дефицитом B12, фолиевой кислоты или железа препаратов, компенсирующих эти дефициты, напротив, количество ретикулоцитов в крови временно возрастает — развивается ретикулоцитоз, который служит признаком усиления эритропоэза. Ретикулоцитоз при этом сохраняется до компенсации анемии (восстановления нормального уровня гемоглобина и эритроцитов) и устранения причины анемии. Изменения характеристик клеток-предшественников эритроцитов в процессе эритропоэзаВ процессе созревания клеток эритроцитарного ростка изменяется их ряд морфологических характеристик. В частности:
Регуляция эритропоэзаПродукция эритроцитов, то есть интенсивность процессов эритропоэза, регулируется петлёй отрицательной обратной связи при участии гормона эритропоэтина. Эта система саморегулируется таким образом, чтобы в нормальном, здоровом состоянии организма скорость производства костным мозгом новых эритроцитов приблизительно соответствовала скорости разрушения «пожилых» (уже деформировавшихся от старости и потому захваченных и разрушенных клетками ретикулоэндотелиальной системы и в частности макрофагами селезёнки), то есть чтобы уровень гемоглобина и эритроцитов в крови оставался приблизительно постоянным. А уровень этот поддерживается таким, чтобы количество гемоглобина и эритроцитов было достаточным для обеспечения адекватного снабжения тканей (и в частности печени и почек) кислородом, но при этом чтобы это количество эритроцитов также не было чрезмерным, вызывающим чрезмерное «сгущение крови», повышение её вязкости, агглютинацию («склеивание») эритроцитов в кровяном русле, чрезмерное увеличение объёма крови и повышение артериального давления, развитие тромбозов, инфарктов или инсультов. Эритропоэтин выделяется в печени и почках в ответ на пониженное содержание в их тканях кислорода (то есть на ухудшение кислородного снабжения ткани печени или почек, чем бы оно ни было вызвано — анемией, спазмом сосудов почек или печени, недостаточным содержанием кислорода в воздухе, заболеванием лёгких или сердца, сосудов — не суть важно, механизм сработает). Кроме того, циркулирующий в крови эритропоэтин связывается циркулирующими эритроцитами, поэтому низкое содержание эритроцитов в крови приводит к повышению количества свободного (не связанного с эритроцитами) эритропоэтина, что приводит к стимуляции производства эритроцитов костным мозгом и к повышению их содержания в крови. Вследствие этого кислородное снабжение печени и почек улучшается (так как эритроцитов и гемоглобина в крови стало больше), снижается продукция ими эритропоэтина, а уровень свободного (несвязанного) эритропоэтина снижается из-за связывания увеличившимся количеством эритроцитов. Таким образом система предотвращает чрезмерное нарастание количества эритроцитов в ответ на стимуляцию и негативные последствия этого чрезмерного нарастания, и самобалансируется. Кроме того, как продукция эритропоэтина почками и печенью, так и продукция красных кровяных клеток костным мозгом находятся под контролем и ряда других гормонов. В частности, стрессовый гормон кортизол также способен как увеличивать продукцию эритропоэтина почками и печенью, так и непосредственно стимулировать эритроцитарный росток костного мозга. Физиологическое значение этого заключается в том, что для реализации стрессовых реакций по типу «бей или беги» повышенная продукция эритроцитов и улучшение кислородного снабжения тканей (особенно мышц, мозга, миокарда) предоставляет преимущество. Значение при патологии — в том, что при недостаточности коры надпочечников (болезни Аддисона) нередко отмечается анемия, а при гиперкортицизме (болезни Кушинга) — нередко чрезмерный эритроцитоз. Также на продукцию эритроцитов положительно влияют половые гормоны, особенно мужские (поэтому содержание гемоглобина и эритроцитов у мужчин выше, чем у женщин), гормоны щитовидной железы, соматотропин, инсулин. Физиологическое значение этого заключается в том, что в период роста и созревания организма ребёнка или подростка, параллельно общему росту, увеличивается и интенсивность процессов эритропоэза. Значение при патологии — в том, что при ряде эндокринных недостаточностей, например, сахарном диабете, гипотиреозе, нередко наблюдается умеренно выраженная анемия, а при состояниях, сопровождающихся гиперпродукцией гормонов (например, тиреотоксикозе), иногда бывает умеренный эритроцитоз. Последние исследования показывают также, что пептидный гормон гепсидин может играть важную роль в регуляции продукции гемоглобина и тем самым в регуляции эритропоэза. Гепсидин производится печенью и регулирует все аспекты обмена железа — скорость абсорбции железа в желудочно-кишечном тракте, скорость высвобождения железа из клеток ретикулоэндотелиальной системы, в частности макрофагов костного мозга, скорость продукции железосвязывающих белков печенью, экскрецию железа почками. А поскольку для того, чтобы эритроциты были способны производить гемоглобин, макрофаги костного мозга должны их снабдить высвобождаемым из них железом, то гепсидин, тем самым, регулирует и скорость образования гемоглобина. Регулятором для уровня гепсидина является содержание железа в печени и в крови. Утрата функции эритропоэтинового рецептора или белка JAK2 в мышиных клетках вызывает нарушение эритропоэза, поэтому продукция красных кровяных клеток у эмбриона мыши нарушается и вместе с этим нарушается нормальный рост и развитие эмбриона. И напротив, если отключить механизм отрицательной обратной связи (супрессоры цитокиновых сигналов) и позволить неограниченную продукцию эритропоэтина, это вызывает у мышей гигантизм (развитие необычно крупных мышек). Нарушения в экспрессии гепсидина в ту или другую сторону приводят к мышкам со врождённой тяжёлой железодефицитной анемией или, наоборот, с гемосидерозом (болезнью накопления железа)[6][7]. См. также
Примечания
Ссылки |