|
Селенистая кислота
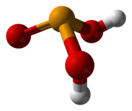
Селе́нистая кислота́ — неорганическое химическое соединение селена, кислота. Химическая формула H2SeO3. Является аналогом сернистой и теллуристой кислот. Селенистая кислота — одна из двух основных оксикислот селена (вторая из них — селеновая кислота H2SeO4). Как и многие другие растворимые соединения селена, она очень сильно ядовита.[1] Физические свойстваБольшие призматические кристаллы.[1] Гигроскопична, расплывается во влажном воздухе.[1][2] Хорошо растворима в воде и этаноле.[1][2] Неустойчивая кислота, при нагревании выше 70 °C плавится с разложением на воду и диоксид селена SeO2.[1][3] Химические свойстваВесьма слабая кислота. В водных растворах диссоциирует:[1][4]
Проявляет окислительно-восстановительную двойственность. Обыкновенно восстанавливается до красного селена, окисляется до селеновой кислоты. Например, реагирует с концентрированными растворами галогеноводородных кислот (кроме фтороводородной), окисляя их до галогенов: В результате этой реакции элементарный селен выпадает в осадок. Ввиду своей относительно сильной окислительной активности, может иметь розоватый цвет ввиду окисления частиц пыли и восстановления дкрасного селена. При реакциях с металлами (например, магнием) даже в разбавленном растворе выделяет и водород, и восстанавливается: Сама селенистая кислота может быть окислена сильными окислителями (хлор и бром в щелочной среде, озон в сильнокислой среде, пероксид водорода) до селеновой кислоты:[1] В результате электролиза водного раствора на катоде выделяется водород, а на аноде — селеновая кислота: ПолучениеСеленистая кислота может быть получена растворением оксида селена(IV) SeO2 в воде: Также может быть получена растворением селена в азотной кислоте, где диоксид селена сразу прореагирует с водой:[1] ПрименениеСеленистую кислоту обычно применяют для травления металлов, например меди или магния, для оксидирования стали в процессе холодного воронения стали, в основном деталей огнестрельного оружия.[5] Применяется для получения глиоксаля окислением ацетальдегида. Основной компонент в реактиве на некоторые наркотические вещества[6]. Используется как источник селена при его дефиците. Также из селенистой кислоты окислением либо электролизом получают селеновую кислоту H2SeO4. ТоксичностьСеленистая кислота очень сильно ядовита. При попадании на кожу вызывает раздражение и химические ожоги. По данным единичных отчётов об отравлениях, смертельная доза составляет от 10 до 20 мг/кг массы тела.[7] См. такжеПримечания
Ссылки
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||








![{\displaystyle {\ce {H2SeO3 + H2O2 ->[t] H2SeO4 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fd27e2d147f8f9a9fd67b480965965322aefb0c)
![{\displaystyle {\ce {H2SeO3 + H2O ->[e^-] H2SeO4 + H2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81631d672ebfdf7d653570a318a6c9ae3266316f)

