|
Гидроксамовые кислоты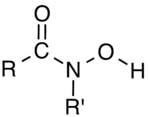 Гидроксамовые кислоты — класс органических соединений, которые содержат функциональную группу RC(O)N(OH)R', где R и R' — углеводородные радикалы. Фактически они представляют собой амиды (RC(O)NHR'), у которых один атом водорода при азоте замещён на гидроксил. Часто используются как хелатирующие агенты металлов. Обладают таутомерией, могут обратимо переходить в гидроксииминовую форму[1]. ИсторияВпервые гидроксамовую кислоту удалось получить в 1869 г. в лаборатории Вильгельма Лоссена. В результате взаимодействия этилоксалата и гидроксиламина была получена оксалогидроксамовая кислота. Чуть позже удалось получить смесь моно-, ди- и трибензоиловых производных гидроксамовых кислот в результате реакции гидроксиламина с хлорангидридом бензойной кислоты[1]. Синтез и реакции Гидроксамовые кислоты обычно получают из сложных эфиров или хлорангидридов карбоновых кислот. Например, синтез бензогидроксамовой кислоты идёт в соответствии со следующим уравнением реакции[2]:
Также гидроксамовые кислоты могут быть получены из альдегидов при помощи реакции Анджели — Римини[англ.]. Наиболее известная реакция с участием гидроксамовых кислот — это перегруппировка Лоссена. Алкилирование приводит к образованию сложных алкиловых эфиров гидроксамовых кислот, а ацилирование хлорангидридами карбоновых кислот — ацильных производных гидроксамовых кислот[1]. Физические свойстваАроматические гидроксамовые кислоты — относительно стабильные кристаллические твердые вещества. В целом, гидроксамовые кислоты — менее сильные кислоты, чем соответствующие им карбоновые (рК около 9)[1]. Координационная химия и биохимия
В области координационной химии гидроксамовые кислоты используются в качестве лигандов[3]. Депротонируясь, они превращаются в бидентатные лиганды гидроксоматы, которые связывают ионы металлов. Сродство гидроксоматов к ионам трёхвалентного железа настолько велико, что в результате эволюции у живых организмов появилось целое семейство гидроксамовых кислот, которые функционируют как лиганды и переносчики ионов железа. Такие вещества называются сидерофоры и используются для поглощения ионов железа всеми бактериями и растениями. Использование этих веществ позволяет растворить нерастворимые соединения трёхвалентного железа. Образовавшиеся комплексы затем транспортируются в клетку, где Fe3+ восстанавливается до Fe2+. Сродство гидроксоматов к Fe2+ значительно меньше, чем к Fe3+, поэтому ион двухвалентного железа легко диссоциирует из такого комплекса. У двудольных, не злаковых и дрожжей восстановление сидерофоров осуществляется внеклеточно, а в клетку поступает свободный ион Fe2+. У злаков, остальных грибов и бактерий сидерофор транспортируется в клетку целиком, и лишь затем подвергается восстановлению[4]. ИспользованиеГидроксамовые кислоты широко используются для флотации редкоземельных минералов. Они применяются для концентрирования и экстракции руд, которые затем подвергаются дальнейшей обработке. Некоторые гидроксамовые кислоты (например, вориностат, белиностат, панобиностат и трихостатин А) являются ингибиторами гистондеацетилазы и поэтому обладают антираковыми свойствами. Дефероксамин, — природное производное гидроксамовой кислоты, — используется в качестве противоядия при отравлении железом. Ещё одна природная гидроксамовая кислота — Фосмидомицин, это ингибитор 1-деокси-D-ксилулозо-5-фосфат редуктоизомеразы (ДКФ редуктоизомераза), а салицилгидроксамовая кислота ингибирует альтернативную оксидазу растений и грибов. Кроме того, ведутся исследования по использованию гидроксамовых кислот для переработки отработанного ядерного топлива. Примечания
Литература
|

