Pentafluoreto de iodo
Alerta sobre risco à saúde
|
|

|
| Outros nomes
|
Fluoreto iódico
|
| Identificadores
|
| Número CAS
|
7783-66-6
|
| PubChem
|
522683
|
| Número EINECS
|
232-019-7
|
| ChemSpider
|
455940
|
| SMILES
|
|
| Propriedades
|
| Fórmula molecular
|
IF5
|
| Massa molar
|
221.89 g/mol
|
| Aparência
|
líquido amarelo pálido
|
| Densidade
|
3.250 g/cm3
|
| Ponto de fusão
|
9.43 °C, 283 K, 49 °F
|
| Ponto de ebulição
|
97.85 °C, 371 K, 208 °F
|
| Solubilidade em água
|
reage [1]
|
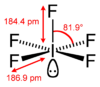
| Estrutura
|
| Estrutura cristalina
|
monoclínico
|
Geometria de
coordenação
|
quadrado piramidal
|
| Forma molecular
|
quadrado piramidal[2]
|
| Riscos associados
|
| MSDS
|
MSDS Externo
|
Principais riscos
associados
|
tóxico, oxidante, corrosivo
|
| NFPA 704
|
|
| Compostos relacionados
|
| Outros aniões/ânions
|
Pentóxido de iodo
|
| Outros catiões/cátions
|
Pentafluoreto de bromo
|
| Compostos relacionados
|
Monofluoreto de iodo
Trifluoreto de iodo
Heptafluoreto de iodo
|
| Página de dados suplementares
|
| Estrutura e propriedades
|
n, εr, etc.
|
| Dados termodinâmicos
|
Phase behaviour
Solid, liquid, gas
|
| Dados espectrais
|
UV, IV, RMN, EM
|
Exceto onde denotado, os dados referem-se a
materiais sob condições normais de temperatura e pressão
Referências e avisos gerais sobre esta caixa.
Alerta sobre risco à saúde.
|
Pentafluoreto de iodo é um composto interhalogênico com a fórmula química IF5. Foi primeiramente sintetizado por Henri Moissan em 1891 pela queima de iodo sólido em gás fluor.[3] Essa reação química exotérmica ainda é usada atualmente para produzir IF5, embora as condições de reação tenham sido aprimoradas.[4][5]

Química
Ele reage vigorosamente com água formando ácido fluorídrico

e também reage com flúor gasoso, formando-se heptafluoreto de iodo.[4]

Aminas primárias reagem com pentafluoreto de iodo formando nitrilas após hidrólise.[6]
Toxicidade
O pentafluoreto de iodo produz uma grande quantidade de gases tóxicos quando derramado na água.[7]
Referências
- ↑ Patnaik, P. (2002). Handbook of Inorganic Chemicals. [S.l.]: McGraw-Hill. ISBN 0-07-049439-8
- ↑ Durbank, R. D.; Jones, G. R. (1974). «Crystal structure of Iodine Pentafluoride at -80° ». Inorganic Chemistry. 13 (5): 421–439. doi:10.1021/ic50135a012
- ↑ Moissan, M. H. (1891). «Nouvelles Recherches sur le Fluor». Annales de Chimie et de Physique. 6 (24): 224–282
- ↑ a b Ruff, O.; Keim, R. (1930). «Das Jod-7-fluorid [The iodine-7-fluoride]». Zeitschrift für Anorganische und Allgemeine Chemie (em alemão). 193 (1): 176–186. doi:10.1002/zaac.19301930117
- ↑ Ruff O.; Keim R. (1931). «Fluorierung von Verbindungen des Kohlenstoffs (Benzol und Tetrachlormethan mit Jod-5-fluorid, sowie Tetrachlormethan mit Fluor) [Fluoridation of Carbon Compounds (Benzene and Tetrachlormethane with Iodine-5-Fluoride, and Tetrachloromethane with Fluorine)]». Zeitschrift für Anorganische und Allgemeine Chemie (em alemão). 201 (1): 245–258. doi:10.1002/zaac.19312010122
- ↑ Stevens, T. E. (1966). «Rearrangement of Amides with Iodine Pentafluoride». Journal of Organic Chemistry. 31 (6): 2025–2026. doi:10.1021/jo01344a539
- ↑ Associação Portuguesa de Segurança. «Manual de Intervenção em Emergências com Matérias Perigosas» (PDF). p. 292





