|
Imatinib
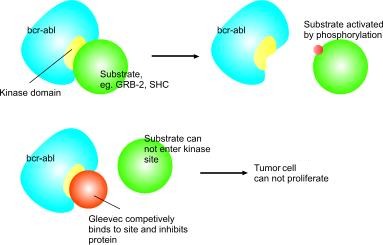
 Imatinib (DCPt[1]) ou Imatinibe (DCB[2]) é um fármaco usado para tratar certos tipos de câncer. Ele é atualmente comercializado pela Novartis como Gleevec (EUA) ou Glivec (Europa/Austrália) como seu sal mesilato, mesilato de imatinib. É usado para tratar leucemia mieloide crônica (LMC), tumores estromais gastrointestinais (GISTs) e diversas outras doenças malignas.[3] Este foi o primeiro genérico para o câncer a ser produzido no Brasil.[4] 1. Conceito O mesilato de imatinibe, introduzido no mercado em 2001 pela Novartis como Gleevec(EUA) ou Glivec, é um inibidor da tirosinoquinase de pequeno peso molecular, que foi inicialmente desenvolvido como derivado da 2-fenilaminopirimidina específico contra o PDGFR. Subsequentemente, foi constatado ser o imatinibe um potente inibidor de ABL quinases, incluindo a proteína de fusão BCR-ABL gerada em consequência da translocação cromossômica t(9;22) (cromossomo Filadélfia) que ocorre na leucemia mieloide crônica (LMC), e verificou-se também que esse agente inibe o receptor de tirosinoquinase C-KIT. 2. Histórico O Imatinibe foi inventado no final dos anos 1990 pelos cientistas da Ciba-Geigy (que se fundiu com Sandoz em 1996 para se tornar Novartis), em uma equipe liderada pelo ioquímico Nicholas Lydon e que incluiu Elisabeth Buchdunger e Jürg Zimmermann e seu uso para tratar LMC foi dirigido pelo oncologista Brian Druker of Oregon Health & Science University (OHSU). Outras importantes contribuições para o desenvolvimento do imatinibe foram feitas por Carlo Gambacorti-Passerini, um médico, cientista e hematologista da Universidade de Milano Bicocca, Itália, John Goldman no Hospital Hammersmith, em Londres, Reino Unido, e mais tarde por Charles Sawyers do Centro Memorial do Cancer Sloan-Kettering. Druker conduziu os ensaios clínicos confirmam sua eficácia na LMC. O imatinibe foi desenvolvido pela rational drug design. Depois que a mutação do cromossomo Filadélfia e hiperatividade da proteína BCR-ABL foram descobertas, os investigadores selecionaram bibliotecas químicas para encontrar uma droga que inibiria a proteína. Com triagem de alto rendimento, eles identificaram a 2-fenilaminopirimidina. Este composto-líder foi então testado e modificada pela introdução de grupos metil e de benzamida para dar-lhe melhores propriedades de ligação, resultando em imatinibe. Um pedido de patente suíço foi arquivado para o imanitibe e vários sais de em Abril de 1992, que foi então arquivado na UE, os EUA e outros países em março e abril de 1993, e em 1996, escritórios de patente estadunidense e europeia patentes emitiram a patente citando Jürg Zimmermann como o inventor. Em julho de 1997, Novartis apresentou um novo pedido de patente na Suíça sobre a forma cristalina beta do mesilato de imatinibe. A "forma cristalina beta" da molécula é um polimorfo específico de mesilato de imatinibe; uma forma específica em que as moléculas individuais se juntam para formar um sólido. Esta é a forma atual da droga vendida como Gleevec / Glivec; um sal (mesilato de imatinibe) em oposição a uma base livre, e a forma cristalina beta, em oposição ao alfa ou outra forma. Em 1998, a empresa Novartis arquivado pedidos de patente internacional, reivindicando prioridade para o depósito de 1997. A patente dos Estados Unidos foi concedida em 2005. Ambas as patentes Novartis US mencionadas aqui - a na forma de base livre de imatinibe, e outra sobre a forma cristalina beta do mesilato de imatinibe - são listados pela Novartis, juntamente com os outros na entrada do Livro Laranja da FDA para Gleevec. O primeiro ensaio clínico de Gleevec começou em 1998 e a droga recebeu aprovação da FDA em maio de 2001, apenas dois anos e meio depois que o pedido da nova droga foi apresentado. No mesmo mês, foi capa da revista Time como uma "bala" para ser usado contra o câncer. Druker, Lydon e Sawyers receberam o Prémio de Investigação Clínica Médica Lasker-DeBakey, em 2009, por "converter um câncer fatal em uma condição crônica administrável”. Durante a revisão da FDA, o nome comercial do medicamento para o mercado norte-americano foi alterada de "Glivec" para "Gleevec", a pedido da FDA, para evitar confusão com Glyset, uma droga contra diabetes. No Brasil, a partir de janeiro de 2013, os hospitais do Sistema Único de Saúde (SUS) começaram a receber o mesilato de imatinibe, o primeiro medicamento genérico nacional contra o câncer. O produto é desenvolvido no laboratório Farmanguinhos, da Fundação Oswaldo Cruz (Fiocruz), no Rio de Janeiro. 3. Usos Clínicos Além do seu principal uso, no tratamento da LMC, o imatinibe também trata efetivamente outros tumores que apresentam mutações relacionadas de tirosinoquinase, incluindo tumores do estroma gastrointestinais-GISTs (impulsionados pela mutação c-KIT), e a síndrome de hipereosinofilia, a leucemia mielomonocítica crônica e o dermatofibrossarcoma protuberante (todos induzidos por mutações que ativam o receptor do fator de crescimento derivado das plaquetas, PDGFR). 4 - Mecanismos de ação O imatinibe (STI-571/Glivec®) é um composto 2-fenilamino-pirimidina e é um inibidor seletivo da enzima tirosino quinase Abl e do gene BCR-ABL. Esse fármaco atua como competidor especifico do receptor celular de ATP do domínio tirosino quinase de Abl e impede a habilidade desta proteína de transferir grupos fosfato de ATP e resíduos de tirosina fosforilada, o que previne a transdução de sinais de energia necessários para a proliferação celular e apoptose.¹ (Figura 1) Figura 1- Mecanismo de ação do imatinibe. Fonte: Vigorito et al, 2006.² 5 - Ações farmacológicas O Imatinibe induz remissão hematológica e citogenética em linhagens celulares Bcr-Abl positivas bem como em células leucêmicas de pacientes com LMC cromossomo Philadelphia (Ph) positivo e leucemia linfoblástica aguda (LLA). Adicionalmente, o Imatinibe também inibe o protooncogene c-Kit e os receptores do fator de célula tronco (SCF), os receptores do domínio de discoidina (DDR1 e DDR2), o receptor do fator estimulante de colônia (CSF-1R) e os receptores alfa e beta do fator de crescimento derivado de plaqueta (PDGFR-alfa e PDGFR-beta). Imatinibe também pode inibir eventos celulares mediados pela ativação desses receptores quinases, mas não inibe outras tirosinas quinases como as da família Src quinase e a mutação T315I de Abl. In vitro, o Imatinibe inibe a proliferação e induz a apoptose das células tumorais do estroma gastrintestinal (GIST), as quais expressam uma mutação de ativação do c-Kit.³ 6. Efeitos colaterais Por ser um medicamento usado para Leucemia Mielóide Crônica (LMC) e para tumor estromal gastrointestinal (GIST) maligno, e a presença de vários sintomas subjacentes às doenças, é de difícil avaliação os efeitos adversos deste medicamento. É um medicamento bem tolerado via oral diário pelos pacientes, sendo a porcentagem de desistência do uso muito baixa entre os pacientes nos diferentes estágios da doença. Os efeitos mais relatados foram: náuseas, vômitos, diarreia, mialgia, cãibras musculares e rash, também foram observado edema periorbitários e de membros inferiores. Retenção hídrica secundária ao medicamento pode causar derrame pleural, ascite, aumento rápido de peso. Esses efeitos podem ser revertidos com a diminuição da dose do Imatinibe ou pelo uso de diuréticos ou outros tratamentos de suporte. Além desses, outros efeitos muito comuns (1 em cada 10 pacientes em tratamento) são: neutropenia, trombocitopenia, anemia, dores de cabeça, dispepsia (indigestão), dores abdominais, espasmos musculares, dores musculares, ósseas e nas articulações e fadiga. Todas essas alterações predispõem o paciente a infecções. Também podem ocorrer efeitos psiquiátricos como depressão, tontura, insônia, parestesias e diminuição da libido. 7. Aspectos Farmacocinéticos Absorção: O fármaco é administrado por via oral e possui uma meia vida de 18 horas, mostrando que uma dose diária é o suficiente. A biodisponibilidade média do imatinibe é de 98%. Apresenta uma taxa de absorção maior quando ingerido em jejum, quando administrado após uma refeição rica em gordura teve uma diminuição de 11% na absorção, aumentando o tempo de concentração máxima. Distribuição: Possui uma ligação às proteínas de 95%, se ligando principalmente a albumina e a alfa-glicoproteína ácida, com baixa ligação as lipoproteínas. Metabolismo: É metabolizado no fígado onde 75% do fármaco é convertido em um metabólito circulante, que é o derivado piperazínico N-desmetilado, que possui uma potência similar ao original. Eliminação: A maioria (81%) do fármaco metabolizado é eliminado nas fezes. E uma pequena parcela (13%) eliminada pela urina. Não há diferença entre homens e mulheres em relação à cinética do imatinibe. Pacientes pediátricos com doses menores possuem a mesma cinética. Paciente com função renal alterada tem uma exposição plasmática maior ao imatinibe, porém, por ser uma via de excreção de menor importância, não justifica um ajuste de dose. A exposição média ao imatinibe não aumentou em paciente com insuficiência hepática em comparação com pacientes com função hepática normal. Referências1. RANG, H.P., DALE, M.M., RITTER, J.M., FLOWER, R.J., HENDERSON, G. Farmacologia. 7° ed. Rio de Janeiro: Elsevier, 2012. 2.LOPES, Nei R.; ABREU, Maria Theresa C. L.. Inibidores de tirosino quinase na leucemia mieloide crônica. Rev. Bras. Hematol. Hemoter., São Paulo , v. 31, n. 6, p. 449-453, 2009 . Available from <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-84842009000600014&lng=en&nrm=iso>. access on 08 Oct. 2016. Epub Dec 11, 2009. http://dx.doi.org/10.1590/S1516-84842009005000089. 3. Vigorioto A, Chiatone C, Souza CA et al. Análise do tratamento atual da leucemia mielóide crônica no Brasil: um estudo de 703 pacientes tratados com mesilato de imatinib em diversas instituições do País. In: 1° Prêmio Saúde Oncologia da América Latina; 2006 abr/mai; São Paulo. 4. Glivec®: mesilato de imatinibe. São Paulo: Novartis Biociências S.A. Resp.: Flavia Regina Pegorer – CRF-SP 18.150. Bula de remédio. Disponível em: https://portal.novartis.com.br/upload/imgconteudos/1821.pdf
1. Brunton, L.L. Goodman & Gilman: As Bases Farmacológicas da Terapêutica. 12ª ed. Rio de Janeiro: McGraw-Hill, 2012. 2. Rang, H.P., Dale, M.M., Ritter, J.M., Flower, R.J., Henderson, G. Farmacologia. 7ª ed. Rio de Janeiro: Elsevier, 2012. 3. Golan, D.E., Tashjian, A.H., Armstrong, E.J., Armstrong, A.W. Princípios de Farmacologia: A Base Fisiopatológica da Farmacoterapia. 2ª ed. Rio de Janeiro: Guanabara Koogan, 2009. 4. A Conversation With Brian J. Druker, M.D., Researcher Behind the Drug Gleevecby Claudia Dreifus, The New York Times, 2 November 2009 Druker BJ, Lydon NB (January 2000). "Lessons learned from the development of an abl tyrosine kinase inhibitor for chronic myelogenous leukemia". J. Clin. Invest. 105 (1): 3–7. 5. Rio produz primeiro medicamento genérico do país contra o câncer. Encontrado em: http://g1.globo.com/rio-de-janeiro/noticia/2012/12/ministro-da-saude-recebe-1-lote-de-medicamento-oncologico-no-rio.html. Acesso em 09/10/2016 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||