|
Cloreto de alumínio
O cloreto de alumínio, ou tricloreto de alumínio, de fórmula química AlCl3, é um sal, preparado pela adição de ácido clorídrico e alumínio metálico, que libera H2 gasoso. Ele reage violentamente com água (formando-se cloreto de hidrogênio). É conhecido como sal anidro (sem água),ou como sal hexaidratado, perde água aos 100°C. O cloreto de alumínio pode ser obtido fazendo a passagem do cloro sobre óxido de alumínio aquecido e carbono. O cloreto de alumínio é usado comercialmente como um catalisador no craqueamento do petróleo, é também usado como catalisador em reações orgânicas. Existe também um sal de cloreto de alumínio (I) (AlCl), mas é muito instável e apenas conhecido em seu estado gasoso. EstruturaCloreto de alumínio anidroNo estado sólido, o cloreto de alumínio cristaliza a segundo a estrutura padrão YCl3 com íons Al3 + formando uma face centrada cúbica. Cloreto de alumínio hexahidratadoO cloreto de alumínio hexahidratado, de fórmula [Al(H2O)6]3+ é estável, não agressivo à pele, e pode até mesmo ser usado na composição de pomadas e loções para tratamento de transtornos dermatológicos (ver hiperidrose). Principais sinônimos:
ReatividadeAlCl3 é um ácido de Lewis sendo provavelmente o mais comumente usado e mais poderoso. Este composto tem muitas aplicações na indústria química, inclusive como um catalisador para as reações de Friedel-Craft, tanto na alquilação e acilação. Ele também é usado para reações de polimerização e isomerização de compostos orgânicos. O cloreto de alumínio é capaz de reagir de acordo com as reações ácido-base de Lewis com bases de Lewis, como até mesmo as mais fracas de benzofenona ou mesetileno. Na presença de um ião cloreto, reage de modo a formar-AlCl4. Sua forma anidra tem uma estrutura especial: embora seja um halogeneto de um metal altamente electropositivo, as ligações químicas são principalmente covalentes (e não iônicas como se poderia esperar). Este resultado faz com que AlCl3 sofra derretimento à temperaturas baixas e sublimação (178 °C para o último), e que o estado líquido tenha baixa condutividade elétrica contrariamente a outros halogenetos iônicos tais como cloreto de sódio. Este composto existe na forma sólida, sob o formar uma rede hexacoordenada. E se funde formando um dímero tetracoordenado, o Al2Cl6 pode se pulverizar, dissociando-se em temperatura mais elevada para formar uma espécie AlCl3 semelhante ao BF3. O cloreto de alumínio é muito reativo, e pode explodir em contacto com a água durante a hidratação. Ele hidrolisa parcialmente na presença de água para formar o ácido clorídrico e / ou cloreto de hidrogênio. Em solução aquosa, o AlCl3 está completamente ionizado e a solução tem a maior potência. Esta solução é ácida. Em termos simplificados, o cátion produzido pela reação de cloreto de alumínio com a água é: A hidrólise parcial na presença de água forma ácido clorídrico e / ou cloreto de hidrogênio. Soluções aquosas de cloreto de alumínio se comportam da mesma forma que as soluções de outros sais hidratados contendo íons Al3 +. Por exemplo, quando confrontada com a quantidade de soda, que faz um precipitado gelatinoso de hidróxido de alumínio: AlCl3 (aq) + 3 NaOH (aq) → Al (OH)3 (s) + 3 NaCl (aq) PreparaçãoO cloreto de alumínio é produzido industrialmente pela reação direta do alumínio e do cloro. 2 Al + 3 Cl2 → 2 AlCl2 Ou de alumínio e ácido clorídrico 2 Al + 6 HCl → AlCl3 + 3 H2 Esta reação é exotérmica. UtilizaçãoA principal utilização de cloreto de alumínio a fabricação de compostos por reação de Friedel e artesanato, que é um catalisador, tais como o fabrico de antraquinona (corante para a indústria), a partir de benzeno e fosgênio. Durante a reação de Friedel-Craft, um acil ou cloreto de alquil halogeneto reage com um aromático como o seguinte:
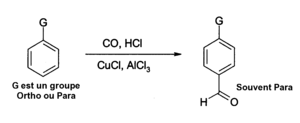
O Cloreto de alumínio também pode ser usado em reações de inserção aldeídos funções em anéis aromáticos, por exemplo, após uma reação Gatterman-Koch, que utiliza o monóxido de carbono, ácido clorídrico e cloreto de cobre (I) como co-catalisador: Cloreto de alumínio tem muitas outras aplicações em química orgânica. Ele catalisa a reação, por exemplo, a de Diels-Alder, como a adição de 3-buteno-2-um sobre a carvão: AlCl3 também é usado em reações de polimerização ou isomerização de compostos orgânicos. As aplicações importantes incluem a produção de etilbenzeno (utilizada para produzir estireno e poliestireno), e produção de dodecilbenzeno (usada para fabricar detergentes). SegurançaAlCl3 pode causar uma explosão se entrar em contato com uma base ou água. Este é um reagente para ser usado com cuidado, usando luvas e óculos de segurança. Deve ser manuseado sob um capuz. Quando tratados com ar úmido, o cloreto de alumínio absorve umidade rapidamente e tornar-se altamente ácido, rapidamente atacando um grande número de materiais, incluindo o aço inoxidável e a borracha. Referências gerais
1. ↑ Número de índice 013-003-00-7 na Tabela 3.1 do anexo VI do Regulamento CE N ° 1272/2008 [arquivo] (16 de Dezembro de 2008) Referências |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||