|
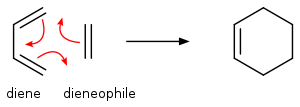
CicloadiçãoUma cicloadição é uma reação química pericíclica, na qual duas ligações π são perdidas e duas ligações σ são ganhas ou, noutra definição, "duas ou mais moléculas insaturadas (ou partes da mesma molécula) combinam com a formação de um aduto cíclico em que há uma redução líquida da multiplicidade de ligações."[1] A reação resultante é a reação de ciclização. Muitas, mas não todas as cicloadições, são reações concertadas. Como uma classe de reação de adição, as cicloadições permitem a formação de ligações carbono-carbono sem o uso de nucleófilo ou eletrófilo. Cicloadições podem ser descritas usando dois sistemas de notação. Uma notação mais antiga, mas ainda comum, é baseada no tamanho dos arranjos lineares de átomos nos reagentes. Usa parênteses: (i + j + …) onde as variáveis são os números de átomos lineares em cada reagente. O produto é um ciclo de tamanho (i + j + …). Neste sistema, a reação de Diels-Alder padrão é uma cicloadição (4 + 2), uma cicloadição 1,3-dipolar tal como a primeira etapa da ozonólise é uma cicloadição (3 + 2) e a ciclopropanação de um carbeno com um alqueno é uma cicloadição (2 + 1).[1] Uma notação mais recente, preferencial segundo a IUPAC, usa colchetes para indicar o número de elétrons, em vez de átomos de carbono, envolvidos na formação do produto. Nesta notação [i + j + …], tanto a reação de Diels-Alder padrão como a cicloadição 1,3-dipolar são reações de cicloadição [4 + 2], e a reação entre o norbornadieno e um alquino ativado é uma cicloadição [2+2+2].[1] Tipos de Sobreposição de OrbitaisExistem dois tipos de sobreposição de orbitais: antarafacial e suprafacial. Dizemos que a sobreposição é suprafacial se ambas ligações σ se formam do mesmo lado do sistema π. Quando as duas novas ligações σ são formadas em lados opostos do sistema π, a sobreposição é chamada de antarafacial.[2]  
Ambas as sobreposições são permitidas por simetria. Em uma reação de cicloadição onde ocorre a formação de produtos com anéis menores, forma-se ligação suprafacial. Isso ocorre porque a tensão geométrica dos anéis pequenos é maior, o que torna esse tipo de aproximação mais favorável. Por outro lado, quando ocorre a formação de anéis maiores, a formação da ligação antarafacial é mais favorável.[2] Ao analisar os orbitais de fronteira de uma reação de cicloadição [4 + 2], ocorre uma sobreposição suprafacial dos orbitais na qual, para formarem-se as duas novas ligações σ, ocorre a sobreposição de orbitais de mesma fase. Nesse caso, o HOMO de qualquer um dos materiais de partida pode ser usado com o LUMO do outro.[2] Por outro lado, quando a reação é do tipo cicloadição [2 + 2], a reação não ocorre em condições térmicas, somente em condições fotoquímicas. Em condições térmicas,a sobreposição suprafacial não tem simetria permitida, e a sobreposição antarafacial não é possível devido ao pequeno tamanho do anel.[2] Cicloadições térmicas e sua estereoquímicaCicloadições térmicas são aquelas em que os reagentes estão no estado eletrônico fundamental. Elas costumam ter (4n + 2) elétrons π participantes no material de partida, com n inteiro. Essas reações ocorrem, por razões de simetria de orbital, de modo suprafacial-suprafacial ou antarafacial-antarafacial (mais raramente). Existem alguns exemplos de cicloadições térmicas as quais têm 4n elétrons π; esses prosseguem em um sentido suprafacial-antarafacial, tal como a dimerização de ceteno, na qual o conjunto ortogonal de orbitais p permite que a reação avance via um estado de transição cruzado. Cicloadições fotoquímicas e sua estereoquímicaCicloadições nas quais 4n elétrons π participam podem também ocorrer via ativação fotoquímica. Nesse caso, um componente tem um elétron promovido do HOMO (ligação π) ao LUMO (antiligante π*). A simetria de orbital é, então, tal que a reação pode ocorrer de modo suprafacial-suprafacial. Um exemplo é a reação de DeMayo. Outro exemplo é mostrado abaixo: a dimerização fotoquímica do ácido cinâmico.[3] Os dois alquenos trans reagem cabeça-a-cauda e os isômeros isolados são chamados ácidos truxílicos. Efeitos supramoleculares podem influenciar estas cicloadições. A cicloadição de trans-1,2-bis(4-piridil)eteno é direcionada por resorcinol no estado sólido em rendimento de 100%.[4] 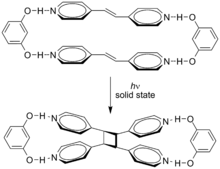 Algumas cicloadições, em vez de ocorrerem a partir de ligações π, operam através de anéis ciclopropano tensos, pois esses têm significativos caráteres π. Por exemplo, um análogo para a reação de Diels-Alder é a reação quadriciclano-DMAD : 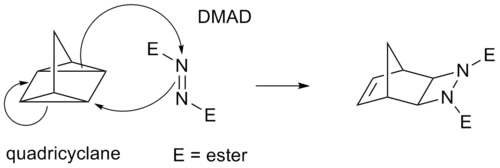 Tipos de cicloadiçãoAs duas principais reações de cicloadição são: Reações de Diels-AlderA reação de Diels-Alder é, talvez, a reação de cicloadição mais importante e comumente ensinada. Formalmente, é uma reação de cicloadição [4+2] e ocorre em uma grande variedade de formas, incluindo a reação de Diels-Alder de demanda inversa de elétrons (ou de demanda inversa eletrônica), reação hexadesidro Diels-Alder e a relacionada trimerização de alquino. A reação pode também ocorrer em sentido inverso na reação retro-Diels-Alder.[5] Reações envolvendo heteroátomos são conhecidas, incluindo a reação de Aza-Diels-Alder e a reação de Diels-Alder de imina. Cicloadições de HuisgenA reação de cicloadição de Huisgen é uma cicloadição (2+3). Cicloadição nitrona-olefinaA cicloadição de nitrona-olefina é uma cicloadição (3+2). Cicloadição [2+2] de olefina catalisada por ferroCatalisadores ferro[piridina(di-imina)] contêm um ligando redox ativo no qual o átomo central de ferro pode coordenar-se com duas ligações duplas de olefinas não funcionalizadas. O catalisador pode ser descrito como um híbrido de ressonância entre uma estrutura contendo elétrons não pareados com o átomo de ferro central no estado de oxidação II e uma na qual o ferro está no estado de oxidação 0. Isso lhe dá flexibilidade para se envolver na união das ligações duplas à medida que elas sofrem uma reação de ciclização, gerando uma estrutura ciclobutano via eliminação C-C redutiva; alternativamente, uma estrutura ciclobuteno pode ser produzida por eliminação de hidrogênio beta. A eficiência da reação varia substancialmente dependendo dos alquenos usados, mas o projeto racional da geometria do ligando pode permitir a expansão da gama de reações que podem ser catalisadas.[6][7] Reações queletrópicasReações queletrópicas são uma subclasse de cicloadições.[8] A característica distintiva de reações queletrópicas é que, em um dos reagentes, ambos as novas ligações estão sendo feitas no mesmo átomo. O exemplo clássico é a reação de dióxido de enxofre com um dieno. OutrasHá outras reações de cicloadição: cicloadições [4+3], cicloadições [6+4], fotocicloadições [2+2] e fotocicloadições [4+4], por exemplo. Cicloadições formaisCicloadições, muitas vezes, têm reações radicalares análogas catalisadas por metal. No entanto, estas não são estritamente reações pericíclicas. Quando, em uma reação análoga a uma cicloadição, intermediários radicalares ou carregados estão envolvidos ou quando a ciclização resultante é obtida a partir de uma série de etapas reacionais, essa reação é eventualmente chamada de cicloadição formal para fazer-se a distinção com cicloadições pericíclicas verdadeiras. Um exemplo de uma cicloadição formal [3+3] entre uma enona cíclica e uma enamina catalisada por n-butil-lítio é uma reação de adição 1,2 em cascata conhecida como reação de Stork:[9] ![Reação de [3+3] cicloadição formal intermolecular](http://upload.wikimedia.org/wikipedia/commons/thumb/2/26/3%2B3-cycloaddition.svg/600px-3%2B3-cycloaddition.svg.png) Cicloadições formais [4 + 2] entre várias 3-etoxiciclobutanonas e alil-tri-alquilsilanos resultam em 3-etóxi-5-[(trialquilsilil)metil]ciclohexanonas por catálise com cloreto de estanho (VI). O rearranjo 1,5 de hidreto induzida por alil-tert-butildifenilsilano, o qual resulta em 2-[3-(tert-butildifenilsilil)propil]-6-metiltetra-hidro-4-pironas.[10] Referências
|