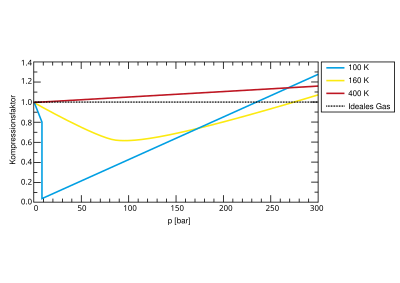
De samendrukbaarheidsfactor voor stikstof in functie van de druk bij verschillende temperaturen De samendrukbaarheidsfactor (Z ) van een gas wordt in de thermodynamica gedefinieerd als:
Z
=
p
V
n
R
T
{\displaystyle Z={\frac {pV}{nRT}}}
Hierbij is p de druk , n het aantal mol ,
T
{\displaystyle T}
absolute temperatuur en
R
{\displaystyle R}
gasconstante .
Voor een ideaal gas is Z = 1. Voor een reëel gas kan Z zowel > 1 zijn als < 1, maar bij voldoende hoge drukken is Z steeds > 1.
De toestandsvergelijking van een reëel gas wordt soms uitgedrukt als een machtreeks :
Z
=
1
+
B
V
m
+
C
V
m
2
+
D
V
m
3
+
…
{\displaystyle Z=1+{\frac {B}{V_{\mathrm {m} }}}+{\frac {C}{V_{\mathrm {m} }^{2}}}+{\frac {D}{V_{\mathrm {m} }^{3}}}+\dots }
Kritische samendrukbaarheidsfactor
Een belangrijke parameter die een reëel gas karakteriseert is de kritische samendrukbaarheidsfactor
Z
c
=
p
c
V
c
n
c
R
T
c
{\displaystyle Z_{c}={\frac {p_{c}V_{c}}{n_{c}RT_{c}}}}
toestandsvergelijking van Van der Waals berkent men een waarde van 3/8 = 0,375, een waarde die vrij sterk verschilt van de geobserveerde waarden:
Bronnen, noten en/of referenties
↑ a b Goodstein, David (1985). States of Matter General Publishing Company, Ltd. , Toronto, Ontario , Canada , "6", 452 . ISBN 0-486-64927-X ↑ a b c d e de Boer, J. (April 1948). Quantum theory of condensed permanent gases I the law of corresponding states . Physica 14 : 139–148 (Elsevier : Utrecht , Netherlands ). DOI : 10.1016/0031-8914(48)90032-9 .