|
求電子剤求電子剤(きゅうでんしざい、英: electrophile)あるいは求電子試薬(—しやく)、求電子種(—しゅ)とは、異なる化学種の間で電子の授受をともないながら化学結合を生成する反応において、電子を受け取る側、奪う側の化学種を指す、有機化学などで使われる用語である。 これに対し、電子を与える側の化学種は求核剤(nucleophile)と呼ばれる。 名称「electrophile」という呼称は「nucleophile」とともに、クリストファー・ケルク・インゴールドにより提唱された。かつて日本では「electrophile」の訳に親電子の語が当てられた為に親電子剤と呼ばれることもある。求電子剤を機構の説明で図示する際に、その英語名から E と略される。 概要求電子剤は、反応する対象となる求核剤の、電子密度の高い部位に対して攻撃を行う。有機反応の多くは電子対の授受であるため、その場合は求電子剤をルイス酸と見なすこともできる。 求電子剤には、陽イオン(H+、NO+ 求電子性と酸性について求電子剤の反応性の強弱を求電子性(きゅうでんしせい、electrophilicity)と呼ぶ。ある化学反応を考えるにあたり、ある化学種について「求電子性が大きい」というときは、反応相手(求核剤)の電子に対する親和性が高く反応速度が大きいことを示している。例として下図の反応で説明する。 E+ = 求電子剤、Nu- = 求核剤、k = 反応速度定数 このような反応で、「E+ の求電子性が大きい」というときは、「k が大きい」ことを示している。
A = ルイス酸、:B = ルイス塩基、 このような反応で、「A の酸性が大きい」というときは、「Ka が大きい」ことを示している。
ブロンステッド酸(H+ を与える酸)の場合の酸性度は、共役塩基との酸塩基平衡反応と、そこでの酸解離定数 (例:Ka = [A-][H+] / [AH])を用いて同様に考える。 有機化学における求電子剤求電子付加はアルケンが起こす主要な反応のうちの1つである。
シクロプロパン環も、求電子付加を受けやすい基質である。
付加アルケンに対して求電子付加を起こす求電子剤の代表例として、ハロゲン(Br2、I2 など)、ハロゲン化水素(HCl、HBr など)が挙げられる。それらの付加反応を例にとり、生成物と、求電子付加反応の代表的な機構とをあわせて示す。 臭素の付加アルケンに臭素 (Br2) が求電子付加すると、1,2-ジブロモアルカンを与える。例えば、エチレンに臭素が付加すると、1,2-ジブロモエタンが得られる。この反応は、以下のような機構で段階的に進行する[1]。
3 の段階で生成物の立体化学が決まるため、通常の基質からはアンチ体(トランス体)のジブロモ化合物が得られる(アンチ付加 もしくは トランス付加)。また、水やアルコールなど、求核性を持つ化合物が溶媒などとして共存している場合、ブロモニウムイオン 2 に対してそれらの分子の付加が起こり、アルコールやエーテルなどが得られる。 この機構は、AdE2 機構と呼ばれ、ヨウ素 (I2)、塩素 (Cl2)、スルフェニルカチオン (RS+)、水銀イオン (Hg2+)、ジクロロカルベン (:CCl2) による付加反応においてもあらわれる。IUPAC表記法では AE+AN と表される。
上記 1 の段階で、特に非極性溶媒中では、2分子、もしくは 3分子の臭素の付加体が介在する場合があることが、反応速度論的な検討から知られている。また、臭化物イオンが充分量共存している場合は、1 の段階から直接 3 の段階へ進む機構があらわれる。フェニル基など、カルボカチオンを安定化させる置換基を有する場合は、β-ブロモカルベニウムイオンを中間体として経由する機構が主となる場合がある。
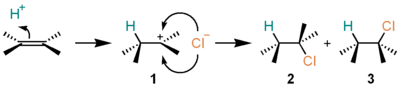
三員環状のブロモニウムイオン 2 は、単離されて構造が決定された例(アダマンチリデンアダマンタンへの付加体など)がある[2]。この構造はβ-ブロモカルベニウムイオンの構造と共鳴の関係にあるため、正電荷は非局在化しており、非古典的カルボカチオンとも呼ばれてきた。 塩化水素の付加アルケンに塩化水素 (HCl) が求電子付加すると、ハロゲン化アルキルを与える。例えば、エチレンに塩化水素が付加すると、クロロエタンが得られる。この反応は、以下のようなカルボカチオンを中間体とする機構で進行する。
いったんカルボカチオン 1 を経由するため、生成物の立体選択性(2 と 3 の生成比)は反応の種類によってまちまちである。一方、非対称アルケンに対する付加の位置選択性(H、Cl が左右どちらの炭素に付加するかの比)は多くの場合マルコフニコフ則に従う。すなわち、より置換度の高いカルボカチオンが中間体となるように、置換度の低い炭素にプロトンが付加する。この機構は、A-SE2 機構と呼ばれ、E1脱離機構の逆の経路をたどって進行している。IUPAC表記法では AH+AN と表される。
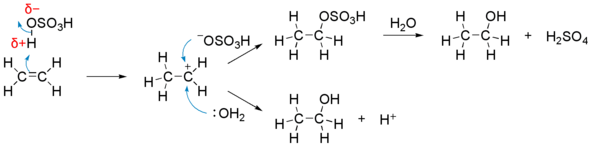
1 の段階において、ハロゲンの付加の場合に見られるような三員環状の中間体は生成せず、類似した構造の遷移状態を経てカルボカチオン 1 まで至ることが理論計算によって予想されている[3]。 フッ化水素 (HF)、ヨウ化水素 (HI) も塩化水素と同様な反応を起こす。一方、臭化水素 (HBr) は条件によってはラジカル付加反応が競争し、マルコフニコフ則に従わない生成物が得られる。ラジカル捕捉剤や相間移動触媒を用いることによってマルコニコフ型の付加物が、過酸化物などのラジカル開始剤の添加によって反マルコフニコフ型の付加物が、それぞれ選択的に合成できる。 水付加これはオレフィンより工業的にエタノールを製造する上で重要なプロセスである。この反応はより複雑で、硫酸などの酸を触媒として用いる。塩化水素の付加と同様に進行するが、 OSO3H 基が OH 基と置き換わってアルコールを与える段階が加わる。 硫酸は最終生成物には含まれないが反応に関与するため、間接的水和法とも呼ばれる。 反応の機構は以下のようなものである。
この過程によって1分子の水が1分子のエチレンに付加し、エタノールとなる。中間体のカルボカチオンに対し、水分子が直接付加してエタノールに変わる経路も共存する。置換基を持つアルケンの場合はマルコフニコフ型付加物のアルコールが得られるが、中間体のカルボカチオンが転位した生成物を与えることもある(ワーグナー・メーヤワイン転位も参照)。 酢酸水銀(II) をアルケンに付加させたのち水素化ホウ素ナトリウムで処理すると、マルコフニコフ型付加物のアルコールが選択的に得られる。 関連項目参考文献 |