塩化ロジウム(III) (えんかロジウム さん、Rhodium chloride)は、代表的なロジウム の塩化物 であり、通常三水和物 を単に塩化ロジウムと呼ぶことが多い。三水和物は各種ロジウム(III)錯体の合成出発物質として用いられる。
無水塩化ロジウム RhCl3 は塩化アルミニウム 型の無限構造を持つ異なる化合物である。
粉末ロジウムを塩素 ガス中で400℃で加熱反応させる。
2
Rh
+
3
Cl
2
⟶
2
RhCl
3
{\displaystyle {\ce {{2Rh}+ 3Cl2 -> 2RhCl3}}}
塩化ロジウム三水和物を塩化水素 中で360℃で加熱分解すると水に不溶性の無水物 が得られる。一方塩化水素中の180℃の加熱では水溶性の無水物が得られる[ 3]
[
RhCl
3
(
H
2
O
)
3
]
⟶
RhCl
3
+
3
H
2
O
{\displaystyle {\ce {[RhCl3(H2O)3] -> {RhCl3}+ 3H2O}}}
粉末ロジウムと塩化カリウム の混合物を550〜575℃で塩素ガスと反応させてヘキサクロロロジウム酸(III)カリウムを得る。この水溶液に水酸化カリウム 水溶液を加え水酸化ロジウム(III)を沈殿させる。水酸化ロジウム(III)を濃塩酸に溶解し、濃縮すると三水和物が析出する。
2
Rh
+
3
Cl
2
+
6
KCl
⟶
2
K
3
[
RhCl
6
]
{\displaystyle {\ce {{2Rh}+ {3Cl2}+ 6KCl -> 2 K3[RhCl6]}}}
[
RhCl
6
]
−
+
3
OH
−
⟶
Rh
(
OH
)
3
+
6
Cl
−
{\displaystyle {\ce {{[RhCl6]^{-}}+3OH^{-}->{Rh(OH)3}+6Cl^{-}}}}
Rh
(
OH
)
3
+
3
HCl
⟶
[
RhCl
3
(
H
2
O
)
3
]
{\displaystyle {\ce {{Rh(OH)3}+ 3HCl -> \ [RhCl3(H2O)3]}}}
褐赤色粉末で、高温で合成したものは水に不溶性である。結晶は三方晶系 ないし単斜晶系 で、三方晶系ものの格子定数 は三方晶系として単位格子をとればa = 4.898Å 、c = 6.81Å、菱面体としてとればa = 3.617Å、α = 84°48′である[ 1]
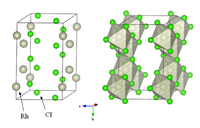
塩化ロジウムの結晶構造
塩化ロジウムの三水和物 RhCl3 •3H2 O は水に可溶な暗赤色固体で、徐々に潮解 する性質がある。濃塩酸 から再結晶 できる。ウィルキンソン触媒 など、有機合成で用いられる触媒の原料となる。
結晶を溶解したばかりの新鮮な水溶液は硝酸銀 を加えても塩化銀 の沈殿を生成せず、塩化物イオンはロジウムに配位結合していると予想される[ 4]
^ a b 『化学大辞典』 共立出版、1993年
^ D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.I. Nuttal, K.L. Churney and R.I. Nuttal, The NBS tables of chemical thermodynamics properties, J. Phys. Chem. Ref. Data 11 Suppl. 2 (1982).
^ 日本化学会編 『新実験化学講座 無機化合物の合成II』 丸善、1977年
^ F.A. コットン, G. ウィルキンソン著, 中原 勝儼訳 『コットン・ウィルキンソン無機化学』 培風館、1987年


![{\displaystyle {\ce {[RhCl3(H2O)3] -> {RhCl3}+ 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9500021fe6a4d301940adcd27ebacfb364b1cc69)
![{\displaystyle {\ce {{2Rh}+ {3Cl2}+ 6KCl -> 2 K3[RhCl6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a917a71a9bda02c057d764cd67cd12dd9b7b111)
![{\displaystyle {\ce {{[RhCl6]^{-}}+3OH^{-}->{Rh(OH)3}+6Cl^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ca284e71a535811a50d35a8689cb5d70e0dbdb0)
![{\displaystyle {\ce {{Rh(OH)3}+ 3HCl -> \ [RhCl3(H2O)3]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9236dd883b1fb4072687c34baba16ee8d63a830f)