| ヒダントイン
|

|
|
|
| 識別情報
|
| CAS登録番号
|
461-72-3
|
| PubChem
|
10006
|
| ChemSpider
|
9612
|
| 日化辞番号
|
J2.588G
|
| KEGG
|
C05146
|
| ChEBI
|
|
| ChEMBL
|
CHEMBL122334
|
|
|
InChI=1S/C3H4N2O2/c6-2-1-4-3(7)5-2/h1H2,(H2,4,5,6,7) Key: WJRBRSLFGCUECM-UHFFFAOYSA-N InChI=1/C3H4N2O2/c6-2-1-4-3(7)5-2/h1H2,(H2,4,5,6,7) Key: WJRBRSLFGCUECM-UHFFFAOYAD
|
| 特性
|
| 化学式
|
C3H4N2O2
|
| モル質量
|
100.08 g mol−1
|
| 融点
|
220°C
|
| 水への溶解度
|
39.7 g/L (100°C)
|
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。
|
ヒダントイン(Hydantoin)は複素環式化合物の一つ。構造上はグリコール酸と尿素の環状縮合物に当たることからグリコリル尿素(Glycolylurea)とも呼ばれる。またイミダゾリジンの2位と4位の炭素原子がカルボニルになった「2,4-イミダゾリジンジオン」とも見られる。遊離のヒダントインは、天然には糖蜜に存在する[1]。ヒダントインは1861年、アドルフ・フォン・バイヤーによりアラントイン(Allantoin)の水素化(Hydrogenation)によって得られ、これにより命名された。
合成法
アミノ酸とシアン酸カリウムから(5-置換)ヒダントイン誘導体が得られる(ユーレクのヒダントイン合成:1873年ユーレクにより発見[2])。
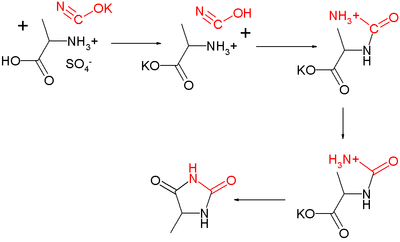
またシアノヒドリンと炭酸アンモニウムから5,5-ジ置換ヒダントイン誘導体を得ることができる(ブヘラ・ベルクス反応:ストレッカー合成の変法)[3][4][5]。
利用
ヒダントインを加水分解するとグリシンが得られる。同様に5-置換ヒダントインの加水分解により各種アミノ酸が得られる。
誘導体
ヒダントイン骨格を持つ化合物には、生物由来のアラントインのほか、次のようなものがある[6]。
参考文献
- ^ 『岩波理化学辞典』第5版
- ^ Urech, F. (1873). “XXI. Ueber Lacturaminsäure und Lactylharnstoff”. Ann. 165: 99. doi:10.1002/jlac.18731650110.
- ^ E. C. Wagner and Manuel Baizer (1940). "5,5-DIMETHYLHYDANTOIN". Organic Syntheses (英語). 20: 42.; Collective Volume, vol. 3, p. 323
- ^ Bucherer, H. T.; Steiner, W. (1934). J. Prakt. Chem. 140: 291.
- ^ Bergs, Ger. pat. 566,094 (1929) [C. A., 27, 1001 (1933)].
- ^ Elinor Ware (1950). “The Chemistry of the Hydantoins”. Chem. Rev. 46 (3): 403-470. doi:10.1021/cr60145a001.

