|
Trasposizione dei grossi vasi
Per Trasposizione dei grossi vasi (TGV) si intende un gruppo di malattie cardiovascolari congenite che provocano una localizzazione anormale di uno o più vasi sanguigni, ovvero la vena cava superiore e/o inferiore, l'arteria polmonare, le vene polmonari, e l'aorta. In sostanza, contrariamente a quanto avviene in un cuore sano, l'aorta esce dal ventricolo destro e l'arteria polmonare dal ventricolo sinistro. In questo modo il circolo vascolare polmonare e quello periferico risultano separati: nel primo scorre soltanto sangue arterioso, nel secondo solo sangue venoso. Le malformazioni riguardanti solo le arterie primarie (arteria polmonare e aorta) sono classificate nel sottogruppo definito trasposizione delle grosse arterie (TGA). Questo tipo di cardiopatie porta spontaneamente alla morte entro pochi mesi dalla nascita, tuttavia, grazie ai progressi che la medicina ha compiuto a partire dagli anni sessanta, è oggi possibile sperare in una completa guarigione del soggetto a seguito di un intervento chirurgico. È considerata una delle più gravi cardiopatie congenite, ma è anche una delle malformazioni che ha più beneficiato della diagnosi prenatale fornita dall'ecografia fetale, che permette di organizzare al meglio le cure per il nascituro[1]. StoriaLa trasposizione dei grossi vasi fu descritta per la prima volta da Matthew Baillie nel 1793.[2] FrequenzaLa TGV rappresenta un 5 - 7% delle cardiopatie congenite. È la più frequente delle cardiopatie cianogene del neonato, prima della Tetralogia di Fallot. La sua incidenza è stimata essere tra i 20 e i 30 casi ogni 100 000 nascite. È due o tre volte più frequente nei maschi piuttosto che nelle femmine. EziologieIl diabete mellito della gestante è un fattore di rischio accertato per il feto affetto da TGV.[3] La prima bambina sopravvissuta ad un intervento chirurgico di correzione della TGV fu Marcie Lynn Thomas, operata all'età di tre mesi nel 1971. Descrizione 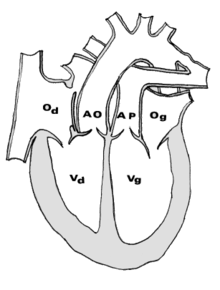   Abbreviazioni: LV e RV = ventricolo sinistro e destro, PT = tronco polmonare, VSD = difetto al setto ventricolare, PS =stenosi polmonare.  Abbreviazioni: RA = atrio destro, RV = ventricolo destro, LV = ventricolo sinistro, PT = tronco polmonare, LPA e RPA = arteria polmonare sinistra e destra. In un cuore sano, il sangue impoverito di ossigeno viene pompato dal lato destro del cuore, attraverso l'arteria polmonare, verso il polmone dove viene ossigenato. Il sangue arricchito di ossigeno ritorna dunque al cuore dal lato sinistro, attraverso la vena polmonare, e viene pompato attraverso l'aorta verso il resto del corpo, inclusa la circolazione coronarica stessa. I vasi trasposti possono presentare una grande varietà di incompatibilità a livello atriovenoso, ventricoloarterioso e/o arteriovenoso. Gli effetti vanno da un cambiamento della pressione sanguigna fino ad una interruzione nella circolazione sanguigna, a seconda della natura e del grado del problema e di quali vasi sono coinvolti. Nonostante letteralmente "trasposizione" indichi uno scambio, molti tipi di TGV coinvolgono vasi collocati in posizioni anomale, ma non necessariamente scambiati tra di loro. I termini TGV e TGA sono comunemente usati in relazione a dextro-TGA (d-TGA) – quando le arterie sono in posizione invertite; tuttavia, entrambi i termini sono comunemente usati, anche se in misura leggermente minore, in relazione a levo-TGA (l-TGA) – nel caso in cui entrambe le arterie e i vetricoli sono scambiati; mentre altri difetti in questa categoria non sono quasi mai identificati con uno di questi termini. TGV semplici e complesseIn molti casi la TGV è accompagnata da altri difetti cardiaci, i più comuni dei quali sono shunt intracardiaci quali difetti del setto atriale(ASD) o del setto ventricolare (VSD), e dotto arterioso pervio (PDA). Possono anche essere presenti stenosi, o altri difetti di valvole e/o di vasi. Alcune di questi difetti possono contribuire a tollerare la TGV al momento della nascita, ma complicano inevitabilmente il decorso operatorio. Nel caso in cui non siano presenti altri difetti cardiaci la TGV viene definita 'semplice' (si tratta di circa il 60% dei casi), altrimenti viene detta 'complessa'. EmbriologiaLa teoria più comunemente accettata oggigiorno è quella di "uno sviluppo anormale del cono", proposta da Vaan Praagh[4]. Il cono è la struttura embriologica che assicura la connessione tra il ventricolo e i grossi vasi che da esso si diramano.
Fisiopatologia
La sopravvivenza immediata è condizionata dalla persistenza di comunicazioni (shunts) che esistono tra i due circuiti prima della nascita: il forame ovale (tra gli atrii) e il dotto arterioso di Botallo (tra l'aorta e l'arteria polmonare). Soltanto in questo modo è consentita la mescolanza tra il sangue desaturato e l'ossigeno. Questi shunts fetali sono destinati ad interrompersi alla nascita, in tempo non prevedibile stimato tra qualche minuto e 48-72 ore. La TGV è dunque una cardiopatia che deve essere immediatamente riconosciuta e trattata. Le forme associate ad una comunicazione interventicolare (CIV) sono solitamente meglio tollerate alla nascita nella misura in cui questa CIV, soprattutto se è estesa, non si fermi rapidamente e permetta un migliore mescolamento del sangue, al prezzo tuttavia di una insufficienza cardiaca. Storicamente, le sole forme che possono sopravvivere spontaneamente qualche mese o qualche anno sono le TGV associate a una estesa CIV e a una stenosi sottopolmonare moderata, poiché quest'ultima limita gli effetti dell'insufficienza cardiaca. DiagnosiPrenataleLa diagnosi della TGV è sempre più frequentemente effettuata prima della nascita, spesso attraverso l'esame ecografico morfologico fatto alla ventiduesima settimana di gravidanza. È possibile comunque avere una diagnosi già dalla dodicesima-quattordicesima settimana, in condizioni di esame particolarmente favorevoli. Aspetti ecografici prima della nascita   Essendo abitualmente le strutture intracardiache in condizioni normali, per la diagnosi si richiede necessariamente l'esplorazione dei grossi vasi attraverso piani di taglio situati più in alto, sopra al torace.
Gestione della gravidanzaLa diagnosi di TGV semplice non deve modificare il decorso della gravidanza ma può comportare una sorveglianza ecografica più stretta e soprattutto suggerire un parto programmato e in prossimità di un centro cardiologico pediatrico adatto alla presa in cura del neonato.
PostpartoQuadro clinicoLa trasposizione dei grossi vasi dovrebbe essere sospettata in un neonato che presenti una cianosi, tanto più se:
Dopo qualche ora di evoluzione possono apparire segni di insufficienza cardiaca (polipnea, tachicardia, macchie, sudorazione, rifiuto del biberon) Esami complementariGli esami che permettono di confermare la diagnosi di TGV sono essenzialmente:
TrattamentoPresa in cura del neonatoNel caso in cui la diagnosi sia stata fatta prima della nascita, è opportuno organizzare il parto in un ospedale in cui è presente un reparto di cardiologia pediatrica. La presa in carico del bambino comincia immediatamente dopo la nascita. A questa fase corrisponde di solito:
Trattamento chirurgicoIl trattamento definitivo della TGV è per via chirurgica. La tecnica è notevolmente evoluta nel tempo, sia per la modalità della correzione sia per l'età alla quale viene praticata. Attualmente è normale che il neonato torni a casa già al quindicesimo giorno di vita, guarito e senza alcun trattamento medico da effettuare dopo la “detrasposizione dei grossi vasi”. Storicamente, sono stati proposti tre tipi di intervento chirurgico, i primi due possono ancora essere utilizzati in casi molto particolari.
Dopo il 1966 è rimasto indicato in casi in cui la manovra di Rashkind non sia sufficiente oppure, come previsto da certe scuole di pensiero come quella di Parigi, al fine di attendere un'età più avanzata(12-24 mesi) per praticare l'intervento definitivo di “correzione a livello atriale”.
Attraverso una nuova partizione degli atrii il sangue venoso proveniente dalle vene è stato reindirizzato verso l'atrio sinistro, il ventricolo sinistro e l'arteria polmonare; il sangue ossigenato proveniente dal polmone è stato mandato verso l'atrio destro, il ventricolo destro e l'aorta. È stata dunque ripristinata una circolazione sanguigna normale, ma non attraverso un'anatomia normale perché i grossi vasi rimangono connessi al ventricolo “sbagliato”. Due chirurghi in particolare hanno associato il loro nome a questo tipo di correzione: Senning nel 1959[7] e Mustard nel 1964[8] e questi interventi sono stati praticati fino agli anni 1975-80. Nonostante alcune complicazioni legate alle lesioni provocate a livello degli atrii (rischio di turbamento del ritmo cardiaco o della circolazione, di stenosi della vena cava o polmonare, soprattutto con il procedimento descritto da Mustard che si basava sull'utilizzo di un patch inerte e quindi incapace di seguire la crescita del bambino[9]) e al mantenimento del ventricolo destro in « posizione sistemica » ovvero sotto l'aorta (rischio di insufficienza cardiaca sul lungo periodo), numerosi bambini sono stati operati secondo tali procedure e oggi sono adulti sani che conducono una vita normale. Nei suoi ultimi anni William Mustard si faceva spesso accompagnare ai convegni di medicina da una giovane donna, madre di famiglia, che era stata una delle prime bambine da lui operate. In Francia, ma anche in altri paesi europei, molti adulti devono la salute al chirurgo George Lemoine, « uomo di grande modestia, troppo poco conosciuto » (Y. Lecompte[10]).
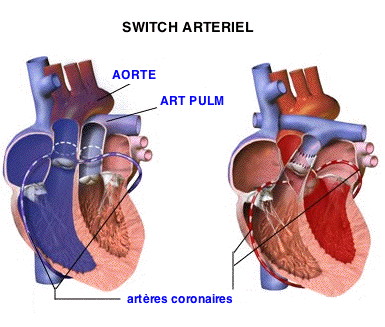 I tentativi ripresero 20 anni dopo, a metà degli anni settanta, dopo la pubblicazione da parte del chirurgo Adib Jatene di una metodologia di detrasposizione praticata con successo su due bambini di tre mesi e 40 giorni[11] e le prime serie di operazioni da parte di Yacoub in Gran Bretagna[12] e dell'équipe del chirurgo Yves Lecompte all'ospedale Laennec di Parigi[13]. Questi nuovi tentativi cercarono di correggere gli errori dei primi, da un lato spostando anche le arterie coronariche sull'aorta, dall'altro controllando la capacità del ventricolo sinistro a reggere lo sforzo sistemico. Questa caratteristica era ottenuta attraverso una sorta di « preparazione » del ventricolo, inserendo per qualche mese un materiale protesico nell'arteria polmonare in grado di obbligare il muscolo a contrarsi per vincere questo ostacolo artificiale. Tale intervento andava praticato però entro la prima settimana di vita. La detrasposizione dei grossi vasi o “switch arterioso” divenne rapidamente l'intervento di riferimento dopo che Yacoub codificò le tecniche che permettevano di adattare l'intervento alle diverse possibili posizioni delle arterie coronariche e dopo che Yves Lecompte inventò nel 1979 un procedimento di svolgimento dei grossi vasi che permetteva un reimpianto dell'arteria polmonare senza l'inserimento di protesi[14], riconosciuto in seguito universalmente come “manovra di Lecompte”. Questa è attualmente l'unica tipologia di intervento praticata, salvo casi particolari. Si tratta di una vera chirurgia correttrice perché prevede la detrasposizione dei grossi vasi reimpiantando l'aorta sul ventricolo sinistro e l'arteria polmonare sul ventricolo destro. La mortalità ospedaliera è attualmente inferiore all'1% per le équipe mediche che praticano questo intervento abitualmente[15], e pertanto si tratta di una vera conquista per la chirurgia neonatale. Questo intervento, in regime di circolazione extracorporea, è stato praticato anche su neonati nati prematuri di appena 2000 grammi. Strategie terapeuticheNei paesi sviluppati la strategia ideale attualmente considerata, e sempre più messa in pratica, è la seguente: diagnostica prenatale e trasferimento in utero in un centro specializzato per mettere in atto la manovra di Rashkind e la somministrazione di prostaglandine. La detrasposizione è effettuata nella prima settimana di vita permettendo un ritorno a casa entro il primo mese. Nei paesi in via di sviluppo, tuttavia, questa strategia comporta un intervento chirurgico e di rianimazione neonatale fuori dalla portata. La diagnosi prenatale di TGV (raramente effettuata) porta ancora spesso alla decisione di interrompere la gravidanza. Si potrebbe tuttavia pensare di attuare una serie di cure di riabilitazione con due opzioni: una manovra Rashkind (magari con un intervento di Blalock-Hanlon complementare), e un intervento di correzione a livello atriale di Senning tra i 6 e i 18 mesi, o manovra Rashkind (con possibile coinvolgimento di Blalock-Hanlon) e imbragatura dell'arteria polmonare seguita da una correzione anatomica di detransposizione tra i 6 mesi e un anno. Queste strategie sono state quelle usate in Francia per poco più di 20 anni e molti bambini, ormai adulti, ne hanno beneficiato. Sviluppo dei bambiniI bambini operati di detrasposizione dei grossi vasi conducono abitualmente una vita totalmente normale, in assenza di trattamenti medici. Solamente gli sport agonistici vengono sconsigliati. Questi bambini devono comunque essere regolarmente seguiti dallo staff medico attraverso una visita annuale o biennale per controllare in maniera puntuale:
GravidanzaSalvo casi particolari (e rari), una donna operata durante l'infanzia di TGV con switch arterioso può ritenere di portare a termine una o più gravidanze senza particolari preoccupazioni. Il parto avrà corso normale e sarà possibile l'allattamento. Consulenza geneticaFino ad oggi non sono state evidenziate delle cause genetiche (o tossiche) per questa malformazione. La TGV è una delle rare malformazioni cardiache che non vengono riconosciute effettuando un'amniocentesi. Note
Voci correlateAltri progetti
Collegamenti esterni
|
||||||||||||||||||
