|
Forza intramolecolareUna forza intramolecolare è una forza che mantiene assieme gli atomi formando molecole o composti, da non confondere con la forza intermolecolare, che è presente tra le molecole e non tra gli atomi.[1] La differenza nel nome deriva dalla radice latina, sia "inter" che "intra" possono essere tradotti con "tra" con la differenza che "inter" viene usato per indicare l'esterno mentre "intra" l'interno.[2] Queste forze sono spesso più forti delle forze intermolecolari, che sono presenti tra atomi o molecole che non sono legate. TipiIl modello classico vede tre principali tipi di legami chimici - ionico, covalente e metallico - differenti per il grado di separazione delle cariche tra gli atomi coinvolti. Le caratteristiche di un legame si possono prevedere dalle proprietà degli atomi costituenti, in particolare dall’elettronegatività. Essi si distinguono per il valore delle loro entalpie di legame, una misura della forza di legame, e questo caratterizza le proprietà chimiche e fisiche dei composti in vari modi. La percentuale di carattere ionico è direttamente proporzionale alla differenza di elettronegatività degli atomi di legame.[3] Legame ionico Un legame ionico consiste in un completo trasferimento di uno o più elettroni di valenza verso gli atomi coinvolti nel processo, dando origine ad un catione (ione positivo) o ad un anione (ione negativo) mantenuti assieme dalla forza elettrostatica.[4] Gli elettroni nel legame ionico tendono ad essere trovati principalmente attorno ad uno o due atomi costituenti a causa della elevata differenza di elettronegatività tra gli atomi stessi (elevata elettronegatività è conseguenza di legami più forti); spesso è descritto come il processo di cessione di un elettrone verso un atomo. Questo tipo di legame generalmente si forma tra metalli e non-metalli, come sodio e cloro nella formazione del cloruro di sodio (). In tale processo il sodio (elemento a bassa energia di ionizzazione) cede un elettrone, trasformandosi in un catione (), mentre il cloro (elemento ad alta affinità elettronica), ottenendo l'elettrone, assume carica negativa diventando un anione (). Per il naturale bilanciamento delle cariche, il legame può essere definito come pura attrazione coulombiana tra cariche di segno opposto, formando il cloruro di sodio ().[5] Legame covalente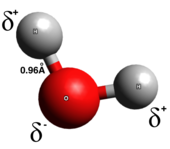 In un vero legame covalente, gli elettroni sono condivisi in modo uniforme tra i due atomi del legame con poca o scarsa separazione di carica. I legami covalenti sono generalmente formati tra due non-metalli. Esistono diversi tipi di legami covalenti: nei legami covalenti polari, è più probabile che gli elettroni si trovino intorno a uno dei due atomi, mentre nei legami covalenti non polari, gli elettroni sono equamente condivisi. Le molecole biatomiche omonucleari sono puramente covalenti. La polarità di un legame covalente è determinata dalle elettronegatività di ciascun atomo e quindi un legame covalente polare ha un momento di dipolo che punta dall'estremità parziale positiva a quella parziale negativa.[6] I legami covalenti polari rappresentano un tipo intermedio in cui gli elettroni non sono né completamente trasferiti da un atomo all'altro né condivisi in modo uniforme. Legame metallicoI legami metallici generalmente si formano all'interno di un metallo puro o di una lega metallica. Gli elettroni metallici sono generalmente delocalizzati; il risultato è un gran numero di elettroni liberi attorno a nuclei positivi, a volte chiamato mare elettronico. Formazione del legameGli atomi formano legami in modo che siano in grado di raggiungere uno stato energetico inferiore. Gli atomi liberi avrebbero più energia di un atomo legato, in quanto, durante la formazione del legame si libera energia, consentendo all'intero sistema di raggiungere uno stato energetico inferiore. La lunghezza del legame, o la distanza minima di separazione tra due atomi che partecipano alla formazione del legame, è determinata dalle loro forze repulsive e attrattive lungo la direzione internucleare.[7] Man mano che i due atomi si avvicinano sempre di più, i nuclei caricati positivamente si respingono, creando una forza che tenta di allontanare gli atomi. Mentre i due atomi si allontanano, le forze attrattive lavorano per rimetterli insieme. In questo modo si ottiene una lunghezza del legame di equilibrio ed è una buona misura della stabilità del legame. Definire il legameÈ possibile difinire matematicamente il tipo di legame che si viene a formare tra due atomi sulla base dell'elettronegatività caratteristica dell'atomo, dato presente in ogni tavola periodica. Chiamato l'elettronegatività del primo atomo ed quella del secondo, il tipo di legame è definito dalla differenza in modulo di tali valori[8]
In particolare se:
Forma e struttura del legameNella formazione di un legame la disposizione degli atomi che formano la molecola non è casuale. In particolare, con la formazione di un legame covalente (sia esso puro o polare), ciò che conferisce alla molecola determinate proprietà è l'angolo di legame, ovvero l'angolo che si forma tra gli assi congiungenti i nuclei degli atomi legati tra loro. Tale angolo presenta rapporti matematici precisi studiati ed esposti nella teoria VSEPR (Valence Shell Electron-Pair Repulsion) che studia quindi la struttura del legame sulla base delle forze repulsive tra gli elettroni del guscio di valenza.[8][3] Secondo tale teoria, avendo gli elettroni segno concorde, sviluppano un comportamento repulsivo tra loro, maggiore nel caso di elettroni liberi e minore tra quelli condivisi in legame, ma sempre minore dell'energia di legame. Nel dettaglio, nel caso di due coppie l'angolo è di 180°, tre coppie determinano un assetto triangolare equilatero con angoli di 120° mentre quattro coppie formano una struttura tetraedrica con angoli di 109,5°; legami doppi o tripli valgono come un singolo legame nella determinazione dell'angolo di legame.[9]  Biochimica Le forze intramolecolari sono estremamente importanti nel campo della biochimica, dove giocano un ruolo importante nella struttura base di strutture biologiche. Le forze intramolecolari come legami disolfuro determinano la struttura di proteine e DNA. La struttura delle Proteine deriva dalle forze intramolecolari che le formano e le tengono insieme. La principale fonte di struttura in queste molecole è l'interazione tra i residui di amminoacidi nella formazione delle proteine.[10] Le interazioni tra i residui delle stesse proteine formano la struttura secondaria della proteina, consentendo la formazione di strutture beta-foglietto e alfa-elica, strutture di fondamentale importanza per le proteine e, nel caso di alfa-eliche, per il DNA. Note
Bibliografia
Voci correlateCollegamenti esterni
|










