|
Tissu lymphoïde associé au tube digestif Le tissu lymphoïde associé au tube digestif, ou tissu lymphoïde du tube digestif (en anglais gut-associated lymphoid tissue, GALT), est le tissu lymphoïde qui constitue le principal support du système immunitaire du tractus gastro-intestinal et dont la fonction première est de protéger l’organisme contre l'invasion par des microbes ou des parasites ingérés.
C’est l’un des cas où un tissu lymphoïde est directement associé à une muqueuse.
Une reconnaissance défectueuse de certains antigènes alimentaires par ce tissu peut provoquer des réactions d'hypersensibilité à certains antigènes alimentaires, tant au niveau local (par exemple au niveau du GALT) que systémique (c’est ce qu’on appelle l’intolérance alimentaire).
Éléments plus précis de définition et terminologie
Au sens strict, le GALT est le tissu lymphoïde associé à l’intestin, mais le terme est généralement utilisé dans un sens plus large, qui inclut les tissus lymphoïdes des autres muqueuses du tractus digestif. Le GALT est lui-même un sous-ensemble du tissu lymphoïde associé aux muqueuses[1].
Structure
Ce tissu lymphoïde n’est pas uniformément présent dans le tube digestif ; il est concentré à plusieurs endroits :
- dans les végétations adénoïdes (également nommée amygdales pharyngiennes ou en latin tonsilla pharyngea) à l’arrière des fosses nasales dans le haut du pharynx, où il est à la fois en contact avec des antigènes apportés par l’air et par les aliments ;
- dans les amygdales palatines (nommées « tonsilles palatines » ou plus souvent et plus simplement « amygdales ») ;
- dans les plaques de Peyer ;
- dans les petits agrégats lymphoïdes situés dans l'œsophage ;
- dans les agrégats lymphoïdes du gros intestin ;
- dans les agrégats lymphoïdes de l’appendice ;
- dans les tissus lymphoïdes de l’estomac (qui grossissent avec l'âge) ;
- dans la « lamina propria » de l'intestin (qui est un tissu conjonctif lâche situé sous les épithéliums impliqué dans les réactions inflammatoires de l’intestin) ; des tissus lymphoïdes y sont présents de manière diffuse sous forme de cellules lymphoïdes et de plasmocytes.
Fonctions
Le tractus digestif est un élément important du système immunitaire, et l'intestin est même l’organe qui possède la plus grande masse de tissu lymphoïde dans le corps humain[2].
Le GALT est en réalité composé de plusieurs types de tissu lymphoïde qui stockent les cellules immunitaires (dont les lymphocytes T et les lymphocytes B qui jouent un rôle essentiel pour la défense de l’organisme contre les agents pathogènes).
Histoire évolutive
Le tissu lymphoïde associé au tube digestif semble jouer un rôle crucial pour la « réponse immune à mémoire » qui permet le système immunitaire adaptatif (SIA) [3].
Ce tissu particulier semble être apparu lors de l'évolution avec les vertébrés à mâchoire (dits gnathostomes). Il pourrait être issu de mutations du système immunitaire inné des invertébrés ou d'un système immunitaire plus proche du nôtre, celui des agnathes (vertébrés sans mâchoire, dominants dans les eaux du paléozoïque inférieur durant plus de 100 millions d'années, mais dont il ne reste aujourd'hui que deux ordres : les pétromysontiformes (lamproies) et les myxiniformes (myxines) qui regroupent moins de 100 espèces[4]). Les facteurs responsable de ce changement évolutif rapide (certains auteurs évoquent à ce propos un big-bang évolutif[5],[6]) ne sont pas encore élucidés[3].
Enjeux
Il apparait important de mieux comprendre et protéger le fonctionnement de ces tissus en raison de leur rôle pour la santé individuelle et collective et pour la santé environnementale.
Ces tissus et leur interface avec la flore microbienne endogène sont en effet un lieu majeur d’interactions durables entre hôte (humain, animal) et les millions de bactéries, micro-champignons et endoparasites ou autres microbes endogènes intestinaux qui se développent dans le tube digestif.
Ils sont en partie responsable de l’immunité acquise, à partir du moment où la flore intestinale se constitue (chez les mammifères à la naissance à partir du système uro-génital maternelle et des microbes acquis dans l'environnement du bébé). Les interactions avec la flore microbienne contribuent à la maturation du tissue lymphoïde associée à l'intestin (GALT). Ces bactéries pionnières modulent l'expression génétique des cellules épithéliales intestinales, prédisposant l’intestin à la colonisation bactérienne.
- Notamment chez le jeune enfant[7], et peut-être déjà lors de leur formation in utero, ces tissus jouent un rôle important dans la tolérance immunitaire acquise ou innée, source d’un équilibre délicat entre l’acceptation par le système immunitaire de l’hôte de la flore intestinale endogène symbiote bénéfique et la non-acceptation d’antigènes externes et de pathogènes exogènes respectivement potentiellement sources d’effets toxiques ou de maladies.
Des interactions précoces (chez l’embryon ou le jeune enfant) et anormales avec certains antigènes (alimentaires notamment) au niveau du tissu lymphoïde associé au tube digestif pourraient être source de pathologies immunotoxicologiques. Diverses études ont montré sur le modèle animal (rat de laboratoire) que ce tissu est en effet vulnérable ou sensible à divers perturbateurs endocriniens[8], en particulier à certains phénols (ex : triclosan[9], bisphénol A dont les effets perturbateurs sur le système immunitaire ont été récemment mis en avant[10],[11]), et qui peuvent contribuer à l’augmentation des réactions inappropriées de l’organisme[12] face à certains aliments, réactions adverses qui semblent, de plus en plus fréquentes[13] dans les pays industrialisées (allergies alimentaires et intolérance alimentaire)[14].
Les effets immunotoxiques de ces produits peuvent être liés à une exposition in utero ou périnatale [15].
- Des travaux scientifiques récents ont montré que certains microbes ou parasites pouvaient contourner le système immunitaire, dont au niveau du tissu lymphoïde associé au tube digestif (ou GALT) ; c’est le cas du HIV qui peut rester actif dans ces tissus, même quand les médicaments ont fortement réduit sa présence dans le sang périphérique[16],[17].
Illustrations complémentaires
-
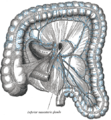
Organes lymphatiques du colon
-
Section de l’œsophage humain ;
-
Lumière intestinale et ganglion lymphatique. (X 20).
-
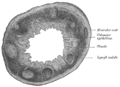
Section de la muqueuse anale humaine ( X 60).
Notes et références
- ↑ (en) Brandtzaeg P, Kiyono H, Pabst R, Russell MW. « Terminology: nomenclature of mucosa-associated lymphoid tissue »
- ↑ Salminen S, Bouley C, Boutron-Ruault MC, et al. (1998). "Functional food science and gastrointestinal physiology and function". British Journal of Nutrition 80 (S1): S147–S171. doi:10.1079/BJN19980108
- ↑ a et b Bleyzac P, Exbrayat J.M & Fellah J.S (2005) Émergence du système immunitaire adaptatif: Hypothèses en présence. M/S: médecine sciences, 21(2), 210-215.
- ↑ Uinuk-Ool T, Mayer WE, Sato A, et al. (2002) Lamprey lymphocyte-like cells express homologs of genes involved in immunologically relevant activities of mammalian lymphocytes. Proc Natl Acad Sci USA 2002 ; 22 : 14356-61.
- ↑ Bernstein RM, Schluter SF, Bernstein H, Marchalonis JJ. Primordial emergence of the recombination activating gene 1 (RAG1): sequence of the complete shark gene indicates homology to microbial integrases. Proc Natl Acad Sci USA 1996 ; 93 : 9454-9
- ↑ Marchalonis JJ, Schluter SF, Bernstein RM, Hohman VS (1998) Antibodies of sharks: revolution and evolution. Immunol Rev ; 166 : 103-22.
- ↑ Dietert, R. R., and Zelikoff, J. T. (2008) Early-life environment, developmental immunotoxicology, and the risk of pediatric allergic disease including asthma. Birth Defects Res. B Dev. Reprod.Toxicol. 83, 547–560
- ↑ Dunbar, B., Patel, M., Fahey, J., and Wira, C. (2012) Endocrine control of mucosal immunity in the female reproductive tract: impact of environmental disruptors. Mol. Cell. Endocrinol. 354, 85–93
- ↑ Clayton, E. M., Todd, M., Dowd, J. B., and Aiello, A. E. (2011) The impact of bisphenol A and triclosan on immune parameters in the U.S. population, NHANES 2003–2006. Environ. Health Perspect. 119, 390–396
- ↑ Rubin, B. S. (2011) Bisphenol A: an endocrine disruptor with widespread exposure and multiple effects. J. Steroid Biochem. Mol. Biol. 127, 27–34
- ↑ Rogers, J. A., Metz, L., and Yong, V. W. (2013) Review: endocrine disrupting chemicals and immune responses: a focus on bisphenol-A and its potential mechanisms. Mol. Immunol. 53, 421–430
- ↑ Skypala, I. (2011) Adverse food reactions–an emerging issue for adults. J. Am. Diet. Assoc. 111, 1877–1891
- ↑ Mansueto, P., Montalto, G., Pacor, M. L., Esposito-Pellitteri, M., Ditta, V., Lo Bianco, C., Leto-Barone, S. M., and Di Lorenzo, G. (2006) Food allergy in gastroenterologic diseases: review of literature. World J. Gastroenterol. 12, 7744–7752
- ↑ Cochrane, S., Beyer, K., Clausen, M., Wjst, M., Hiller, R., Nicoletti, C., Szepfalusi, Z., Savelkoul, H., Breiteneder, H., Manios, Y., Crittenden, R., and Burney, P. (2009) Factors influencing the incidence and prevalence of food allergy. Allergy 64, 1246–1255
- ↑ Braniste, V., Jouault, A., Gaultier, E., Polizzi, A., Buisson-Brenac, C., Leveque, M., Martin, P. G., Theodorou, V., Fioramonti, J., and Houdeau, E. (2010) Impact of oral bisphenol A at reference doses on intestinal barrier function and sex differences after perinatal exposure in rats. Proc. Natl. Acad. Sci. U.S.A. 107, 448–453
- ↑ Moraima Guadalupe,1 Sumathi Sankaran,1 Michael D. George,1 Elizabeth Reay,1 David Verhoeven,1 Barbara L. Shacklett,1 Jason Flamm,4 Jacob Wegelin,3 Thomas Prindiville, 2 and Satya Dandekar. Viral Suppression and Immune Restoration in the Gastrointestinal Mucosa of HIV Type 1-Infected Patients Initiating Therapy during Primary or Chronic Infection Journal of Virology, August 2006, p. 8236-8247, Vol. 80, No. 16
- ↑ Anton PA, Mitsuyasu RT, Deeks SG, Scadden DT, Wagner B, Huang C, Macken C, Richman DD, Christopherson C, Borellini F, Lazar R, Hege KM. Multiple measures of HIV burden in blood and tissue are correlated with each other but not with clinical parameters in aviremic subjects. AIDS. 2003 Jan 3;17(1):53-63
Voir aussi
Articles connexes
Bibliographie
- Adel-Patient K, Bernard H & Wal JM (2008) Devenir des allergènes dans le tube digestif. Revue française d'allergologie et d'immunologie clinique, 48(4), 335-343.
- Braniste V & Houdeau E (2012) L’intestin–une nouvelle cible des perturbateurs endocriniens. Cahiers de nutrition et de diététique, 47(4), 193-200 (résumé).
- Cerf-Bensussan N & Guy-Grand D (1993) Organisation du système lymphoïde associé à l'intestin. Revue française d'allergologie et d'immunologie clinique, 33(3), 197-203 (résumé).
- Crabbé P (1967) Signification du tissu lymphoïde des muqueuses digestives. Éditions Arscia.
- Louis E, Servais B & Belaiche J (1990) L'état inflammatoire physiologique de la muqueuse digestive. Revue Médicale de Liège, 45(6).
- Ruskoné-Fourmestraux, A., Lavergne-Slove, A., & Delmer, A. (2005). Lymphomes primitifs du tube digestif. EMC-Hématologie, 2(4), 259-275.
|