|
Raie spectrale Une raie spectrale est une ligne sombre ou lumineuse dans un spectre électromagnétique autrement uniforme et continu. Les raies spectrales sont le résultat de l'interaction entre un système quantique (généralement des atomes, mais parfois aussi des molécules ou des noyaux atomiques) et le rayonnement électromagnétique. Historique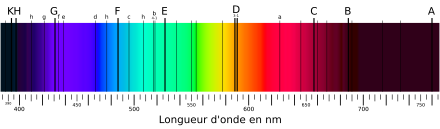 La raie spectrale est un phénomène qui demeura insoupçonné jusqu'aux premières études réalisées avec les prismes sur la décomposition de la lumière. La première observation d'une raie spectrale est celle de la raie d'émission du sodium, effectuée par Thomas Melvill en 1752. À l'aide d'un prisme, il observe la lumière de sels chauffés par une flamme et découvre une raie intense, jaune[1]. La découverte des raies d'absorption remonte au XIXe siècle, en 1802, lorsque William Hyde Wollaston dans ses recherches sur les prismes, observe des raies noires dans le spectre habituellement continu de lumière décomposée. Ces raies ont pour particularité de ne pas changer de position quel que soit le prisme et son matériau. Joseph von Fraunhofer utilise cette observation pour mettre au point une manière de mesurer les longueurs d'onde en prenant ces raies comme référence. Gustav Robert Kirchhoff développe ainsi un système de références, utilisant les raies les plus visibles dans le spectre solaire et les numérotant. Ces raies de références sont par la suite utilisées pour calibrer des instruments de mesure et de spectroscopie[2]. Alors que Fraunhofer établit la mesure de la longueur d'onde de quelques-unes des raies spectrales, c'est Anders Jonas Ångström qui détermine les longueurs d'onde de près d'un millier de raies d'absorption à l'aide de réseaux de diffraction en 1869, supplantant le système des raies de Fraunhofer et de la numérotation de Kirchhoff jusqu'en 1890[2]. Spectroscopie D'abord nommée analyse spectrale, l'étude des raies et des longueurs d'onde d'un spectre devient progressivement la « spectroscopie » dans les années 1880[2]. Description du phénomèneDans un système quantique, l'énergie ne peut pas prendre des valeurs arbitraires : seuls certains niveaux énergétiques bien précis sont possibles. On dit que l'énergie du système est quantifiée. Les changements d'état correspondent donc eux aussi à des valeurs bien précises d'énergie marquant la différence d'énergie entre le niveau final et le niveau d'origine. Si l'énergie du système diminue d'une quantité , un quantum de rayonnement électromagnétique, appelé photon, sera émis à la fréquence (nu) donnée par la relation de Planck-Einstein : où est la constante de Planck. Inversement, si le système absorbe un photon de fréquence , son énergie augmente d'une quantité . Comme l'énergie du système est quantifiée, il en est de même pour la fréquence des photons émis ou absorbés par le système. Ceci explique que le spectre d'un système quantique est constitué d'un ensemble de raies discrètes plutôt que d'un spectre continu où toutes les fréquences sont présentes en quantité variable. Un gaz chaud se refroidit en émettant des photons ; le spectre observé est donc constitué d'un ensemble de raies lumineuses sur un fond sombre. On parle alors de raies d'émission (exemple ci-contre). Inversement, si le gaz est froid mais éclairé par une source continue, le gaz absorbe des photons et le spectre est constitué par un ensemble de raies sombres sur un fond lumineux : on parle alors de raies d'absorption. Les raies d'absorption et d'émission sont fortement spécifiques à chaque substance, et peuvent être employées pour identifier facilement la composition chimique de n'importe quel milieu capable de laisser passer la lumière (généralement, il s'agit de gaz). Elles dépendent également des conditions physiques du gaz, ainsi elles sont largement répandues pour déterminer la composition chimique des étoiles et d'autres corps célestes qui ne peuvent pas être analysés par d'autres moyens, aussi bien que leurs états physiques. D'autres mécanismes que l'interaction atome-photon peuvent produire des raies spectrales. Selon l'interaction physique exacte (avec des molécules, des particules simples, etc.) la fréquence des photons impliqués change considérablement, et on peut observer des raies dans tout le spectre électromagnétique : des ondes radio aux rayons gamma. En pratique, les raies n'ont pas une fréquence parfaitement déterminée mais s'étalent sur une bande de fréquence. Les raisons de cet élargissement sont multiples :
Exemples
Les lampes à décharge produisent les raies d'émission du gaz utilisé. Notes et références
Voir aussiArticles connexes
Liens externes
|






