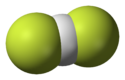|
Bifluorure
L'ion bifluorure (ou hydrogénodifluorure) désigne l'anion de formule HF2−. Cet ion présente la plus forte liaison hydrogène connue, avec une longueur de liaison H-F de 114 pm[2] et une énergie de liaison supérieure à 155 kJ mol−1[3]. Le diagramme d'orbitales moléculaires de l'anion montre que les atomes sont liés entre eux par une liaison à 3 centres et 4 électrons[4]. Certains sels de HF2 sont courants, notamment le bifluorure de potassium KHF2 et le bifluorure d'ammonium (NH4)HF2. L'ion bifluorure participe à l'autoprotolyse de l'acide fluorhydrique HF lors de laquelle les ions H+ et F− issus de son ionisation sont solvatés par HF :
Notes et références
Articles connexes |
||||||||||||||||||||||||