|
Anthéraxanthine
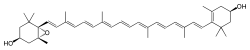
L'anthéraxanthine (du grec ánthos, "fleur" et xanthos, "jaune") est un pigment jaune vif qu'on trouve dans de nombreux organismes photosynthétiques. C'est un pigment du cycle des xanthophylles, chimiquement c'est un alcool liposoluble appartenant au groupe des caroténoïdes, sous-groupe des xanthophylles. L'anthéraxanthine fait partie du système de photoprotection mais en est aussi un produit, chez les organismes photosynthétiques algues vertes, algues rouges, euglénoïdes et plantes[2],[3]. Dans le cycle des xanthophylles L'anthéraxanthine est un intermédiaire du cycle des xanthophylles dans la plupart des eucaryotes, c'est-à-dire les plantes et quelques bactéries. Dans le cycle des xanthophylles, des pigments caroténoïdes spécifiques sont transformés par réactions enzymatiques en pigments conférant une meilleure ou une moins bonne photoprotection[4]. Une plante peut améliorer sa capacité d'extinction non-photochimique et de dissipation de chaleur en excès, par la conversion du pigment orange violaxanthine en anthéraxanthine, puis en le pigment jaune pâle zéaxanthine[5]. Le pool des xanthophylles ou teneur totale en pigments du cycle du xanthophylle est parfois abrégé par "VAZ" dans la littérature scientifique[6]. “VAZ” est précisément l'abréviation des principaux pigments du cycle, selon l'ordre croissant pour le caractère photoprotecteur. L'anthéraxanthine est appelée “A” au milieu de l'abréviation, entre la violaxanthine (V) et la zéaxanthine (Z)[7]. Localisation dans la membrane du thylakoïdeLe cycle des xanthophylles s'établit, ainsi que les autres réactions impliquant des photopigments, dans les membranes des thylakoïdes à l'intérieur des chloroplastes[8]. L'anthéraxanthine apporte par le mécanisme de NPQ une certaine stabilité aux membranes des thylakoïdes par rapport à la chaleur et la lumière, plus que la violaxanthine mais moins que la zéaxanthine[9]. Les réactions du cycle des xanthophylles, dans lequel l'anthéraxanthine est un intermédiaire, sont d'habitude des réponses aux changements lumineux, qui modifie le pH interne des thylakoïdes. Une diminution ou une augmentation de la photoprotection par le cycle des xanthophylles permet aux plantes de régler leur absorption de lumière pour la photosynthèse[7]. La majorité des chloroplastes sont situés dans les cellules du tissu mésophylle d'une plante, juste sous la couche épidermique des feuilles et tiges. Les thylakoïdes étant contenus dans les chloroplastes, l'anthéraxanthine et les autres photopigments présentent leur teneur la plus haute dans les feuilles des plantes exposées à une forte radiation du soleil ou à une forte exposition à la lumière et la chaleur. Une étude à forte altitude sur des pissenlits (Taraxacum officianale) dans les Andes a globalement trouvé de fortes teneurs d'anthéraxanthine accumulée dans les feuilles particulièrement exposés sur une pente nord-ouest à 1600 m, et même de plus fortes teneurs au sommet à 3600 m[10]. Enzymes et réactionsL'anthéraxanthine est une forme de violaxanthine partiellement déépoxydée. L'un des deux groupements époxydes est éliminée de la structure chimique pour produire de l'anthéraxanthine[11]. C'est pour cela que le cycle des xanthophylles est parfois appelé cycle de la violaxanthine. La violaxanthine-dé-époxydase ou VDE est un enzyme qui réduit un groupe époxyde de la violaxanthine, formant ainsi une double liaison, pour produire l'anthéraxanthine. Il fonctionne aussi pour donner de la zéaxanthine, en catalysant la réduction des deux groupements époxydes de la violaxanthine. La zéaxanthine-époxydase ou ZEP catalyse la formation d'un groupement époxyde sur la zéaxanthine pour former de l'anthéraxanthine, et de deux groupements époxydes pour former la violaxanthine[11]. Références
|
||||||||||||||||||||||||||||||