|
Annélation de RobinsonEn chimie organique, l'annélation de Robinson est une réaction qui créé une cétone α,β-insaturée cyclique à 6 membres à partir d'une cétone (ou aldéhyde) et de la méthylvinylcétone[1],[2],[3]. La réaction tient son nom du chimiste britannique Robert Robinson qui l'a découverte à l'université d'Oxford. 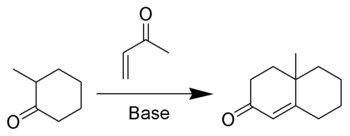 MécanismeLa méthylvinylcétone (ou ses dérivés) est un réactif essentiel de la réaction puisqu'elle est à la fois un accepteur de Michael et qu'elle peut prendre part à une condensation aldolique. La première étape de l'annélation est une addition de Michael suivie par une addition aldolique comme étape de cyclisation. La réaction continue par une étape de déshydratation comme dans une condensation aldolique classique pour former le cycle cyclohexénone.  VariantesAnnélation de Robinson asymétriqueL'original de Wieland-Miescher cétone est racémique et préparé dans une annélation de Robinson du 2-méthylcyclohexane-1,3-dione et la méthyl vinyl cétone[4]. L'annélation de Robinson peut être rendue stéréoselective par l'ajout de L- ou D-proline[5].  Des dérivés de la proline peuvent aussi être utilisés comme pour cette annélation asymétrique du géranial[6] :  Réaction de WichterleLa réaction de Wichterle est une variante de l'annélation de Robinson où la méthylvinylcétone est remplacée par le E-1,3-dichlorobut-2-ène[7],[8],[9].  Annélation de HauserLa séquence réactionnelle de l'annélation de Hauser est addition de Michael - condensation de Dieckman - élimination[10].  ApplicationsLa cétone de Wieland-Miescher est le produit de l'annélation de Robinson de la 2-méthylcyclohexane-1,3-dione et de la méthylvinylcétone(racémique) alors que la cétone de Hajos-Parrish est le produit de la réaction de la 2-méthylcyclohexane-1,3-dione et de la méthylvinylcétone catalysé par la D-proline [11]. 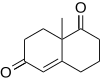 Synthèse énantiomérosélective de la platensimycine Des scientifiques de l'entreprise pharmaceutique Merck ont récemment découvert un nouveau composant aux propriétés antibiotiques pouvant potentiellement avoir des applications médicales, la platensimycine, représentée à droite. La synthèse première conduisait à un mélange racémique du composé mettant en jeu une réaction d'estérification intramoléculaire entre le groupement alcool et la liaison double. Yamamoto a reporté l'utilisation d'une réaction alternative: une annélation de Robinson intramoléculaire qui fournit une synthèse énantiomérosélective du cœur constitué de quatre cycles de la platensimycin. L'avantage de cette étape d'annélation de Robinson serait d'être réalisé en une étape en utilisant une L-proline pour le contrôle chiral. La réaction est décrite ci-dessous[12].  Notes et références
|