|
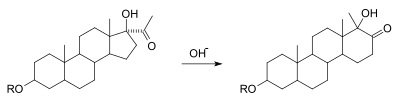
Transposición del ácido bencílicoLa transposición de ácido bencílico es una reacción orgánica que consiste la conversión de la 1,2-difeniletanodiona (ó Benzilo) al ácido 2,2-difenil-2-hidroxietanoico (ácido bencílico) en presencia de hidróxido de potasio. Descrita por primera vez por Justus Liebig en 1838,[1] este tipo de reacción se aplica a 1,2-diarilcetonas en general para obtener ácidos α-hidroxicarboxílicos.[2] Esta reacción de dicetonas está relacionada con otras transposiciones, tales como la reacción de Cannizzaro y la transposición pinacólica.  Mecanismo de reacciónLa reacción es una transposición-1,2 representativa. Estas transposiciones suelen presentar migración de carbocationes, pero en la reacción esto es inusual porque se trata de migración de un carbanión. (V. esquema 2)[3] Un anión hidróxido ataca uno de los grupos cetónicos en una adición nucleofílica (1) para dar el hidroxialcóxido (2). El siguiente paso requiere una rotación de enlaces de tal manera que se obtenga el confórmero 3, el donde el grupo R se encuentra colocado en una posición favorable para el ataque sobre el grupo carbonilo en un segundo paso concertado con la reversión del grupo hidroxilo al grupo carbonilo. Esta secuencia se asemeja a una sustitución nucleófila acílica. Los cálculos demuestran que cuando R es metilo la carga acumulación de este grupo en el estado de transición puede ser tan alto como 0.22 y que el grupo metilo se coloca entre el carbono central de carbono en una separación de 209 pm.   El ácido carboxílico del intermediario 4 es menos básico que el anión hidroxilo y por lo tanto la transferencia de protones se realiza al intermediario 5, que puede ser protonado para obtener el producto final, el ácido α-hidroxicarboxílico 6. Los cálculos muestran que con una descripción precisa de la secuencia de la reacción es posible con la participación de cuatro moléculas de agua que estabilicen la acumulación de carga. También facilitan el traslado eficiente de un protón en la formación del intermedio 5. Desde un punto de vista de orbitales moleculares esta transposición no es obvia. Contrariamente a una transposición carbocatiónica (como en la transposición de Wagner-Meerwein) en donde el orbital vacío del carbocation interactúa positivamente y con la simetría permitida HOMO (orbital pi-ocupado) en el enlace central C-C (Esquema A), un orbital carbaniónico ocupado con un par electrónico no debería poder evolucionar a un translape de orbital molecular de simetría prohibida con el orbital LUMO, el cual es el orbital pi antienlazante vacío que tiene un nodo (Esquema B). En realidad, una dicetona 1,2-LUMO es un sistema de 4 electrones, sin ningún nodo en el centro de enlace C-C y una transición de simetría permitida es posible (Situación C). En otras palabras, los estados de transición de la transposición bencílica obedecen las reglas de Woodward-Hoffmann, debido a que 6 electrones están involucrados según la regla de Hückel.  Una variación de esta reacción se ha reportado en algunos esteroides. En la transposición de los D-homoesteroides, un anillo de ciclopentano se expande a un anillo de ciclohexano con adición de base.[4][5] Referencias
|