|
Síntesis químicaSíntesis química es el proceso por el cual se producen compuestos químicos a partir de compuestos simples o precursores químicos.[1] Su rama más amplia es la síntesis orgánica. También es realizada por los organismos vivientes en su metabolismo, como ejemplo están las proteínas.[1] El objetivo principal de la síntesis química, además de producir nuevas sustancias químicas, es el desarrollo de métodos más económicos y eficientes para sintetizar sustancias naturales ya conocidas, como por ejemplo el ácido acetilsalicílico (presente en las hojas del sauce) o el ácido ascórbico o vitamina C, que se encuentra de forma natural en muchos vegetales. La respiración celular, proceso utilizado por la mayoría de las células animales y vegetales, es la degradación de biomoléculas (glucosa, lípidos, proteínas) para que se produzca la liberación de energía necesaria, y así el organismo pueda cumplir con sus funciones vitales. Mediante la degradación de la glucosa (glucólisis) se forma ácido pirúvico. Este ácido se desdobla a dióxido de carbono y agua, generándose 36 moléculas de ATP. También la síntesis química permite obtener productos que no existen de forma natural, como el acero, los plásticos o los adhesivos. Actualmente hay catalogados unos once millones de productos químicos de síntesis y se calcula que cada día se obtienen unos 2000 más. El progreso científico ha permitido un gran desarrollo de las técnicas de síntesis química, como la síntesis en fase sólida o la química combinatoria. Inicialmente estos productos se obtenían de manera casual mientras que, en la actualidad, es posible realizar simulaciones por ordenador antes de experimentar en el laboratorio..  HistoriaLa historia del desarrollo de la síntesis química es un fascinante viaje que abarca siglos de descubrimientos científicos, experimentación y avances tecnológicos. La síntesis química se refiere al proceso mediante el cual los compuestos químicos complejos se construyen a partir de otros más simples, y su desarrollo ha estado estrechamente ligado al progreso de la química y campos relacionados como la farmacología, la ciencia de materiales y la química industrial. Comienzos (antes del siglo XVII)Las raíces de la síntesis química pueden rastrearse hasta la alquimia, un precursor de la química moderna. Los alquimistas buscaban transmutar los metales comunes en oro y descubrir el "elixir de la vida", mientras exploraban las propiedades de las sustancias. Aunque sus objetivos eran a menudo místicos, los alquimistas sentaron las bases de las técnicas experimentales y desarrollaron formas tempranas de equipos de laboratorio, como los alambiques, que serían cruciales para la síntesis química posterior. Sin embargo, la síntesis química tal como la entendemos hoy no comenzó hasta los siglos XVII y XVIII. La Edad de la Ilustración (Siglos XVII y XVIII)Durante la Revolución Científica, la química comenzó a emerger como una disciplina distinta de la alquimia. Pioneros como Robert Boyle (1627–1691), a menudo llamado el padre de la química moderna, ayudaron a cambiar el enfoque de las prácticas místicas hacia la experimentación empírica. El trabajo de Boyle, El químico escéptico (1661), introdujo el concepto de elementos químicos y reacciones, sentando las bases para el estudio de la síntesis química.[2] En el siglo XVIII, el descubrimiento de los gases y el desarrollo de las primeras comprensiones rudimentarias sobre las reacciones químicas impulsaron más avances. Antoine Lavoisier (1743–1794), conocido como el "padre de la química moderna", desarrolló la ley de conservación de la masa y ayudó a identificar el papel del oxígeno en la combustión, lo cual fue crucial para entender cómo ocurrían las reacciones. Este periodo marcó el inicio de enfoques más sistemáticos para la síntesis química, aunque la mayoría de las reacciones aún eran simples y no capaces de construir moléculas complejas desde cero.[3] Siglo XIX: El auge de la Química OrgánicaEl siglo XIX vio avances rápidos en la teoría y la técnica química, particularmente en la química orgánica. La química orgánica, que se centra en los compuestos que contienen carbono, comenzó a desarrollarse a medida que los científicos empezaron a comprender la estructura y el comportamiento de las moléculas orgánicas. Uno de los primeros logros más importantes en la síntesis química fue la síntesis de la urea por Friedrich Wöhler en 1828. Wöhler sintetizó accidentalmente la urea, un compuesto orgánico, al calentar el cianato de amonio, un compuesto inorgánico[4]. Este experimento desacreditó la idea del "vitalismo", la creencia de que los compuestos orgánicos solo podían ser producidos por organismos vivos, y demostró que los compuestos orgánicos podían sintetizarse a partir de materiales inorgánicos. A mediados y finales del siglo XIX, químicos como August Kekulé[5], Archibald Scott Couper y Aleksandr Butlerov desarrollaron la idea de la estructura molecular, lo que permitió a los químicos comprender cómo se organizaban los átomos dentro de las moléculas. Esta comprensión estructural fue clave para avanzar en la síntesis de compuestos orgánicos. Los químicos también comenzaron a identificar y clasificar los grupos funcionales—agrupaciones específicas de átomos que confieren ciertas propiedades químicas a las moléculas, como los grupos hidroxilo (-OH) o amino (-NH₂).[6] Durante este período, los científicos comenzaron a sintetizar sustancias naturales como alcaloides y azúcares, aunque esto generalmente se hacía de manera rudimentaria. Uno de los primeros esfuerzos sintéticos exitosos fue la síntesis de la quinina, un alcaloide utilizado para tratar la malaria. Esto demostró que las moléculas orgánicas complejas podían fabricarse en el laboratorio, aunque el proceso era lento e ineficiente.[7] Principios del siglo XX: Química Industrial y el nacimiento de la síntesis farmacéuticaA principios del siglo XX, la síntesis química comenzó a industrializarse y comercializarse. El desarrollo de nuevos métodos sintéticos y catalizadores permitió a los químicos producir sustancias químicas de manera más eficiente y en mayores cantidades. A principios del siglo XX también emergió la química de los polímeros. En 1907, Leo Baekeland inventó la baquelita, el primer plástico sintético, que se producía mediante la polimerización de fenol y formaldehído. El desarrollo de los polímeros sintéticos llevaría más tarde a la creación de materiales como el nailon, el teflón y el polietileno, revolucionando industrias que iban desde la textil hasta la electrónica. La industria farmacéutica experimentó un crecimiento significativo a principios del siglo XX, gracias en parte al desarrollo de fármacos sintéticos. En 1928, Alexander Fleming descubrió la penicilina, y su síntesis fue lograda más tarde en el laboratorio, lo que llevó al desarrollo de antibióticos y otros medicamentos salvavidas. El siglo XX también vio el auge de las vitaminas y hormonas sintéticas, lo que amplió aún más el alcance de la síntesis química. El desarrollo de procesos catalíticos, que aceleran las reacciones químicas sin ser consumidos, desempeñó un papel crucial en la síntesis química a escala industrial. En el siglo XX, los métodos catalíticos se aplicaron a procesos como el refinado del petróleo (por ejemplo, la craqueo catalítico del crudo) y la producción de amoníaco (mediante el proceso de Haber-Bosch), lo que revolucionó la producción de fertilizantes y la industria alimentaria a nivel mundial. ProcedimientoLa síntesis química comienza seleccionando los compuestos químicos que se conocen como reactivos. Varios tipos de reacciones químicas se pueden aplicar para sintetizar un producto final o un producto intermedio y puede que se requiera una serie de pasos antes de aislar los productos.[8] El rendimiento es la cantidad de producto obtenido y se expresa en gramos o en porcentaje de la cantidad teórica que debería haberse producido. Puede haber reacciones indeseadas que disminuyen los rendimientos. EstrategiasExisten muchas estrategias en la síntesis química que son más complicadas que simplemente convertir un reactivo A en un producto de reacción B directamente. Para la síntesis de varios pasos, un compuesto químico se sintetiza mediante una serie de reacciones químicas individuales, cada una con su propio procesamiento.[9] Por ejemplo, una síntesis de laboratorio de paracetamol puede constar de tres partes secuenciales. Para las reacciones en cascada, ocurren múltiples transformaciones químicas dentro de un solo reactivo, para las reacciones de múltiples componentes, hasta 11 reactivos diferentes forman un solo producto de reacción y para una " síntesis telescópica"un reactivo experimenta múltiples transformaciones sin aislamiento de intermedios. Síntesis orgánicaLa síntesis orgánica es un tipo especial de síntesis química que se ocupa de la síntesis de compuestos orgánicos. Para la síntesis total de un producto complejo, se pueden requerir múltiples procedimientos en secuencia para sintetizar el producto de interés, requiriendo una gran cantidad de tiempo. Habilidad en la síntesis orgánica es muy apreciado entre los químicos y la síntesis de compuestos excepcionalmente valiosos o difíciles ha ganado químicos tales como Robert Burns Woodward un Premio Nobel de Química. Si una síntesis química parte de compuestos básicos de laboratorio, se considera un proceso puramente sintético. Si parte de un producto aislado de plantas o animales y luego procede a nuevos compuestos, la síntesis se describe como un proceso semisintético . Síntesis inorgánicaLa síntesis inorgánica y la síntesis organometálica se aplican a la preparación de compuestos con un contenido no orgánico significativo. Un ejemplo ilustrativo es la preparación del fármaco contra el cáncer cisplatino a partir de tetracloroplatinato de potasio. [4] 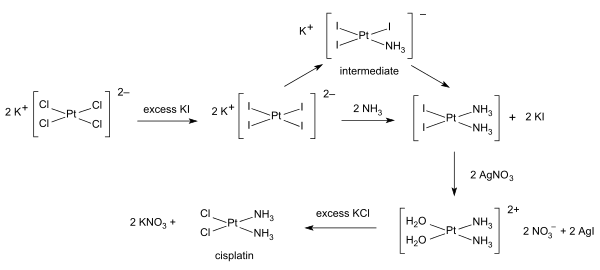 Síntesis de gasesEn principio, el gas de síntesis se puede producir a partir de eductos (materiales de partida) sólidos (s - sólido), líquidos (l - líquido) y gaseosos (g - gaseosos). Gas de síntesis a partir de eductos sólidosEn la producción de gas de síntesis a partir de materiales de partida sólidos, la gasificación del carbón es particularmente importante. Carbón - C(s) se produce en una mezcla de oxidación parcial (parcial/incompleta) con aire u oxígeno puro - O2(g) y gasificación con vapor - H2O(g) a una mezcla de monóxido de carbono - CO(g) e hidrógeno - H2(g). Debido al equilibrio de Boudouard, el CO(g) todavía está en equilibrio con C(s) y dióxido de carbono – CO2(g): Además, hay que tener en cuenta el equilibrio gas de agua: La reacción exotérmica con el oxígeno proporciona la energía necesaria para alcanzar la alta temperatura de reacción para la reacción endotérmica. reacción de gasificación del carbón con vapor de agua. La composición del gas de síntesis puede controlarse mediante una hábil selección de la materia prima (en función del contenido deseado de monóxido de carbono e hidrógeno). Dado que el carbón contiene otros elementos además del carbono (azufre, nitrógeno, vanadio, ...), el gas de síntesis obtenido aún debe limpiarse y procesarse después del reactor. Sobre todo hay que eliminar el agua, el CO2, el hollín y el H2S. Además del carbón, se prevé el uso de otros sólidos como: La biomasa (madera, paja) es concebible, pero también es necesario un tratamiento previo de los materiales de entrada y un tratamiento posterior o limpieza del gas de síntesis. Gas de síntesis a partir de eductos líquidosDiversos destilados del petróleo crudo pueden utilizarse como reactivos líquidos para el gas de síntesis, tanto las fracciones de bajo punto de ebullición como las de alto punto de ebullición. Los destilados de bajo punto de ebullición pueden convertirse tras eliminar el azufre mediante reacción con vapor utilizando el proceso de reformado con vapor. El proceso de reformado con vapor es una reacción endotérmica que se lleva a cabo en un catalizador heterogéneo (reacción que utiliza pentano como ejemplo): Cuando se utilizan fracciones de aceite de alto punto de ebullición (residuo viscoso flasheado, véase craqueo), se lleva a cabo una oxidación parcial, que no requiere catalizador (reacción utilizando pentano como ejemplo): Gas de síntesis a partir de reactantes gaseososEl reactante gaseoso más importante para la producción de gas de síntesis es el gas natural. En comparación con los demás eductos, el gas natural suministra la mayor proporción de hidrógeno en relación con el monóxido de carbono. Reformado con vaporEl gas natural se hace reaccionar con vapor mediante el proceso de reformado con vapor: La empresa Linde es uno de los mayores fabricantes con 4.000 sistemas construidos y los llama planta HyCO, al igual que SynGas como HyCO (hidrógeno-CO).[10] Convertidor de plasmaUn proceso de dos etapas desarrollado en 2012 produce gas de síntesis, que se compone únicamente de monóxido de carbono e hidrógeno. En el primer paso, el metano se descompone en una mezcla de carbono e hidrógeno utilizando plasma a más de 1000 °C[11] (reacción: CH4 + energía → C + 2 H2 ). En el segundo paso, se añade CO2 a la mezcla de carbono e hidrógeno. El carbono y el CO2 reaccionan a altas temperaturas para formar monóxido de carbono (reacción: C + CO2 → 2 CO). Alternativamente, se puede utilizar agua en lugar de CO2 para obtener una mayor concentración de hidrógeno en el gas de síntesis. [12] En este caso la segunda reacción es: C + H2O → CO + H2. Junto con el hidrógeno del primer paso, ambas alternativas producen un gas de síntesis de alta pureza, que se compone únicamente de CO y H2.[13] La proporción de CO a H2 se puede variar en cada caso. Si el gas de síntesis se adapta a un proceso de síntesis posterior (p. ej., síntesis de Fischer-Tropsch, DME, gasolina y alcohol), se produce un proceso PGtL (PGtL - Power-and-Gas-to-Liquid). [14] Síntesis industrialesLas reacciones de síntesis química más importantes se utilizan para producir una materia prima (por ejemplo: proceso de Haber-Bosch para la síntesis de amoníaco; producción de metilclorosilanos como intermedio para la producción de siliconas), o para la producción de un ingrediente activo ( por ejemplo: síntesis de ácido acetilsalicílico a partir de fenol). La síntesis de sustancias quirales (fármacos, pesticidas, etc.) con una estructura tridimensional uniforme se puede realizar mediante síntesis enantioselectiva o catálisis enantioselectiva. Las síntesis a menudo reciben el nombre de sus descubridores, por ejemplo, la síntesis de Reppe, la Síntesis de Fischer-Tropsch o síntesis de Asinger.[15] Ámbitos en los que la síntesis es esencialCatalizadoresLa catálisis es fundamental para una amplia gama de procesos industriales, que abarcan tanto la fabricación de productos químicos a granel como de productos químicos finos. El diseño racional, la síntesis y la optimización de sistemas catalizadores son, por tanto, cruciales para el desarrollo de procesos más eficientes, selectivos y tolerantes con el medio ambiente. La investigación en este campo se centra tanto en los sistemas que contienen metales como en los que no, y su objetivo no es sólo mejorar los catalizadores de los procesos existentes, sino también lograr transformaciones catalíticas totalmente nuevas.[16] Medicina y descubrimiento de fármacosEl desarrollo de nuevos productos farmacéuticos es un aspecto sumamente importante de la síntesis orgánica. Esta tarea permite descubrir y optimizar moléculas complejas con una actividad biológica potente y selectiva. La comprensión de la química sintética permite equilibrar las propiedades químicas para que las moléculas se comporten como se desea en células y pacientes. El desarrollo de nuevas reacciones es otra faceta esencial de este trabajo, porque abre rutas antes inaccesibles a nuevos compuestos.[16] Nuevos materialesLa preparación de materiales funcionales con propiedades diseñadas a medida (por ejemplo, electrónicas, ópticas, magnéticas) es fundamental para lograr avances en ámbitos como las baterías, el desarrollo de células solares, los superconductores, los materiales inteligentes, etc., que son muy prometedores para las tecnologías del futuro. Numerosos laboratorios cuentan con una larga trayectoria en este campo.[16] Biología químicaLa síntesis de moléculas diseñadas para interactuar con sistemas biológicos y sondearlos es muy útil para investigar y comprender los procesos que intervienen en los sistemas vivos. Estos compuestos nos permiten comprender mejor los procesos biológicos fundamentales y contribuir al descubrimiento de fármacos mediante la validación eficaz de dianas.[16] Productos naturalesLa historia de los medicamentos, los aromas y los productos agroquímicos ilustra la importancia capital de los productos naturales. La química sintética es muy útil para imitar a la Naturaleza y nos permite preparar moléculas complejas que se producen de forma natural pero sin alterar la propia fuente. Estos productos naturales, y sus análogos, tienen innumerables usos como fármacos, aromatizantes y agroquímicos.[16] Obtención de imágenesLos tintes y sondas sintéticos han tenido una gran importancia en los últimos avances en el campo de la imagen, lo que permite utilizar técnicas más potentes y menos intrusivas en la búsqueda de tejidos enfermos o dañados.[16] Véase tambiénReferencias
Bibliografía
|




