|
Síntesis de quinolinas de KnorrLa Síntesis de quinolinas de Knorr es un método de síntesis orgánica donde se convierte una β-cetoanilida en una 2-hidroxiquinoleína con ácido sulfúrico. Esta reacción fue descrita por primera vez por Ludwig Knorr (1859 - 1921) en 1886.[1]  La reacción es un tipo de sustitución electrófila aromática acompañada por una eliminación de agua. Un estudio de 1964 encontró que con ciertas condiciones de reacción se forma una 4-hidroxiquinoleína como reacción en competencia.[2] Por ejemplo, la benzoilacetanilida (1) forma la 2-hidroxiquinolina (2) con un gran exceso de ácido polifosfórico (PPA), pero se forma la 4-hidroxiquinoleína 3 cuando la concentración del PPA es baja. Un mecanismo de reacción identifica un intermediario N,O dicatiónico con exceso de ácido capaz de cerrar automáticamente el anillo y un intermediario monocatiónico B que se fragmenta en anilina y acetofenona (en última instancia). La anilina reacciona con otro equivalente de benzoilacetanilida antes de formar la 4-hidroxiquinoleína.
 Un estudio en 2007[3] revisó el mecanismo de reacción, y basado en espectroscopia de RMN y cálculos teóricos se llegó a la conclusión de que se forma un intermediario O,O-dicatiónico (un superelectrófilo) sobre el intermediario N,O dicatiónico. Por cuestiones prácticas se recomienda´ácido tríflico: 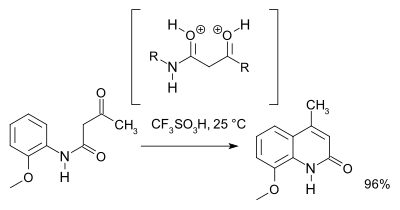 Referencias
Véase también
|