|
Síntesis de aminoácidos de Erlenmeyer-PlöchlLa síntesis de aminoácidos de Erlenmeyer-Plöchl fue descubierta por primera vez en 1893 por el químico alemán Friedrich Gustav Carl Emil Erlenmeyer que condensó el benzaldehído con N-acetilglicina en presencia de anhídrido acético y acetato de sodio (incluso hay casos en los que se pueden usar cantidades catalíticas de base (del 10% mol), pero en vez de acetato de sodio, se emplea fosfato de potasio). La reacción va vía condensación de Perkin seguida de la ciclación de la N-acetilglicina produciendo las llamadas azlactonas de Ernelmeyer. Estas azlactonas de Erlenmeyer son realmente oxazolonas.[1][2] Por la síntesis de Erlenmeyer de azlactonas se pueden sintetizar a partir de la reacción de un aldehído aromático con un ácido carboxílico aromático (como por ejemplo el ácido hipúrico) en presencia de anhídrido acético.  Mecanismo de la síntesisEl mecanismo ya se ha comentado que se trata de dos reacciones acopladas: Reacción de Perkin + ciclación del ácido aromático correspondiente[3]  Hasta aquí se describe la obtención de la azlactona u oxazolona. Preparación de α-cetoácidosA partir de la oxazolona puede producirse por hidrólisis los α-cetoácidos correspondientes:  Preparación de α-aminoácidosSi antes de la hidrólisis se hace una reducción con H2 (hidrógeno) se obtienen los correspondientes aminoácidos: 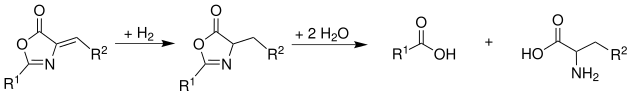 Síntesis de fenilalaninaComo puede observarse en la siguiente figura, el ácido hipúrico[4] se autocondensa en presencia del anhídrido acético para formar la 2-fenil-oxazolona.[5] Este intermedio también tiene dos protones ácidos y reacciona con benzaldehído, anhídrido acético y acetato de sodio para formar una azlactona u oxazolona. Este compuesto al reducirlo da la fenilalanina.[6]  Extensión de la síntesisEn un estudio se utilizó la síntesis de aminoácidos de Erlenmeyer para la síntesis del aminoácido tirosina[7] Referencias
|
