|
Supergrupo SAR
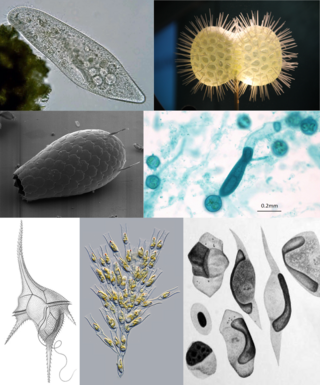
SAR o Harosa (informalmente el supergrupo SAR) es un clado de Eukarya que incluye a Stramenopiles (Heterokonta), Alveolata y Rhizaria.[1][2][3][4] La primera letra de cada grupo proporciona el nombre "SAR" (alternativamente deletreado "RAS").[5] Comprende organismos muy diversos, desde algas unicelulares y pluricelulares hasta depredadores y parásitos, incluyendo ciliados, flagelados, ameboides y seudohongos. El supergrupo comprende unas 50.000 especies descritas.[6] GruposLa monofilia del supergrupo se sustenta solo sobre la base de datos moleculares, pero son robustos, pues se han obtenido en numerosos análisis filogenéticos, incluyendo similitudes en genes y proteínas. Los tres grupos que forman parte del supergrupo SAR son en sí mismos muy diversos e incluyen tanto organismos fotosintéticos como heterótrofos, muchos de ellos parásitos. A menudo los parientes más cercanos de miembros fotosintéticos son especies parásitas. StramenopilesStramenopiles o Heterokonta es un grupo de protistas caracterizado por la presencia de dos flagelos heterocontos, uno liso y otro con mastigonemas, dirigidos en sentidos opuestos, si bien algunos grupos han perdido uno de los flagelos y otros no tienen ninguno. Es un grupo muy diverso que incluye organismos fotosintéticos unicelulares como las diatomeas o pluricelulares como las algas pardas, además de organismos heterótrofos e incluso parásitos como los oomicetos y Blastocystis, este último patógeno para los seres humanos. AlveolataLos alveolados se caracterizan por la presencia de alvélos corticales, un sistema de vesículas que soporta y da rigidez a la membrana plasmática. Es un grupo muy diverso que incluye organismos fotosintéticos tales como los dinoflagelados, pero también otros heterótrofos como los ciliados, además de los apicomplejos, que son exclusivamente endoparásitos, incluyendo los coccidios y los Plasmodium, causantes de enfermedades muy graves a los seres humanos. RhizariaLos rizarios constituyen un grupo muy diverso, soportado solo sobre la base de caracteres moleculares y abarcando organismos ameboides, flagelados y ameboflagelados. Incluye amebas desnudas, con testa o caparazón, con filopodios o reticulopodios, como en el caso de foraminiferos y radiolarios, que son organismos heterótrofos de vida libre. Además incluye organismos parásitos como Phytomyxea y Ascetosporea, y también dos grupos fotosintéticos, Paulinella y Chlorarachniophyta. Ejemplos
CloroplastosLa mayoría de los organismos fotosintéticos del supergrupo SAR presentan cloroplastos que, por la presencia de tres o cuatro membranas y de clorofilas a y c, se cree procedentes de la endosimbiosis secundaria de un alga roja. Añadido al supergrupo SAR otros dos grupos, Cryptophyta y Haptophyta, presentan cloroplastos procedentes de un alga roja, pero no se puede decidir si esto es el resultado de un único evento de endosimbiosis o de varios independientes.[7] La situación se complica pues muchas veces los parientes más cercanos de organismos fotosintéticos son heterótrofos o parásitos. Por ejemplo, en el caso de las algas dinoflageladas, los parientes más cercanos son los apicomplejos, que son exclusivamente endoparásitos de animales y de los seres humanos. Sin embargo, en este caso la relación está clara, pues los apicomplejos presentan un orgánulo, el apicoplasto, claramente derivado de un antiguo cloroplasto. Además, dos grupos de rizarios (que son en su mayoría heterótrofos) poseen cloroplastos con clorofilas a y b.[8] Así, los cloroplastos de Chlorarachniophyta están rodeados por cuatro membranas y poseen un nucleomorfo, por lo que se supone son resultado de la endosimbiosis secundaria de un alga verde. El caso de Paulinella chromatophora es muy especial: estudios recientes sugieren que sus cloroplastos son el resultado de una endosimbiosis primaria de una cianobacteria. Es el único caso conocido de obtención de cloroplastos por endosimbiosis primaria, aparte del que dio origen a Archaeplastida. Otros posibles casos de obtención de plastos primarios han sido debatidos, como el caso de la diatomea Rhopalodia, que presenta un orgánulo de fijación de nitrógeno, con un origen presuntamente cianobacterial.[9] Por último, algunos dinoflagelados como Karlodinium micrum han reemplazado sus cloroplastos procedentes de la endosimbiosis secundaria de un alga roja por otros procedentes de la endosimbiosis terciaria de un alga haptófita. La situación se complica porque estudios recientes han revelado la presencia de genes procedentes de algas rojas en los genomas de Chlorarachniophyta, así como de genes procedentes de algas verdes en las diatomeas.[10] Cavalier-Smith ha sugerido que pudo haber dos endosimbiosis secundarias, una procedente de un alga roja y otra de un alga verde; es decir, que estos organismos se originaron a través de dos endosimbiosis secundarias, aunque después la mayoría de los grupos perdieron los cloroplastos procedentes de las algas verdes, que solo se mantuvieron en Chlorarachniophyta.[11] En resumen, la situación es bastante confusa y no se puede descartar ninguna de las hipótesis. Papel ecológicoEl supergrupo SAR incluye algunos de los organismos fotosintéticos más importantes de la Tierra, desde las algas unicelulares componentes del plancton hasta las pluricelulares algas pardas, que forman bosques submarinos. También incluye a organismos unicelulares heterótrofos, como los paramecios y otros que son parásitos, como los Plasmodium. Árbol filogenético y antigüedadEl siguiente árbol filogenético muestras las relaciones entre los grupos de SAR de acuerdo con los análisis moleculares:[12][13]
Los restos fósiles más antiguos corresponden a dinoflagelados que datan del Mesoproterozoico hace 1500-1200 millones de años y se conocen como Shuiyousphaeridium y Dictyosphaera. Ambos presentan dinoesteranos como biomarcador.[14] Otro fósil más antiguo Palaeovaucheria es de a finales del Mesoproterozoico hace 1000 millones de años el cual es una alga verde-amarilla. Este fósil presenta filamentos multicelulares cuya morfología y dimensión son propios un organismo eucariota, asemejándose al alga verde-amarilla contemporánea Vaucheria.[15][16] DefiniciónEl término SAR fue propuesto por Burki (2007)[2] como una abreviatura que acomodara a los tres grupos citados, puesto que en los árboles filogéneticos constituyen un clado. El término Harosa fue introducido por Cavalier-Smith (2010)[11][17] para referirse a un subreino de Chromista, dividido en los mismos tres grupos que él considera infrarreinos. Posteriormente Adl et al. (2012) formalizaron el supergrupo SAR como taxón definiéndolo de la siguiente forma:
Anteriormente, los miembros del supergrupo SAR estaban distribuidos entre los supergrupos Chromalveolata y Rhizaria. Sin embargo, los estudios filogenéticos confirmaron que Stramenopiles y Alveolata forman un clado junto a Rhizaria, y aparentemente excluyen a Haptista y Cryptista. Por tanto, el supergrupo SAR quedó constituido por Stramenopiles + Alveolata + Rhizaria, mientras que Okamoto et al. (2009)[18] propusieron el grupo Hacrobia (actualmente se discute si es un clado o no) para acomodar a Haptista + Cryptista.[7] Véase tambiénReferencias
Enlaces externos
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||