|
Reloj epigenéticoUn reloj epigenético o reloj por metilación de ADN es una prueba bioquímica que se puede usar para medir la edad. La prueba se basa en los niveles de metilación del ADN. HistoriaLos fuertes efectos de la edad en los niveles de metilación del ADN se conocen desde fines de la década de 1960.[1] Una vasta literatura describe conjuntos de islas CpG cuyos niveles de metilación del ADN se correlacionan con la edad.[2][3][4][5][6] La primera demostración sólida de que los niveles de metilación del ADN en la saliva podrían generar predictores de edad precisos fue publicada por un equipo de la UCLA, incluido Steve Horvath en 2011 (Bocklandt et al 2011).[7][8] Los laboratorios de Trey Ideker y Kang Zhang de la Universidad de California en San Diego publicaron el reloj epigenético Hannum (Hannum 2013)[9] que constaba de 71 marcadores que calculan con precisión la edad en función de los niveles de metilación de la sangre. El primer reloj epigenético basado en múltiples tejidos, el reloj epigenético de Horvath, fue desarrollado por Steve Horvath, profesor de genética humana y de bioestadística en la UCLA (Horvath 2013).[10][11] Horvath pasó más de 4 años recolectando datos de metilación de ADN Illumina disponibles al público e identificando métodos estadísticos adecuados.[12] La historia personal detrás del descubrimiento se presentó en Nature.[13] El estimador de edad se desarrolló utilizando 8,000 muestras de 82 conjuntos de datos de matriz de metilación de ADN Illumina, que abarca 51 tejidos sanos y tipos de células. La principal innovación del reloj epigenético de Horvath radica en su amplia aplicabilidad: el mismo conjunto de 353 islas CpG y el mismo algoritmo de predicción se utiliza independientemente de la fuente de ADN dentro del organismo. Es decir, no requiere ningún ajuste o compensación. Esta propiedad permite comparar las edades de diferentes áreas del cuerpo humano usando el mismo reloj de envejecimiento. Poco después, se desarrolló una derivación del reloj de Horvath, el IEAA (Intrinsic Epigenetic Age Acceleration), un estimador basado en la composición celular de la sangre. Una segunda generación de relojes epigenéticos surgió unos años más tarde y mejoró a la primera en la estimación de la edad. Esto fue gracias a la incorporación no solo de variantes epigenéticas como la metilación del ADN sino también variantes ambientales como el tabaquismo o la edad cronológica. Dentro de estos relojes destacan el reloj PhenoAge y el GrimAge. PhenoAge es un reloj epigenético que tiene en cuenta la edad cronológica, y GrimAge utiliza los riesgos de mortalidad de la edad junto con la variante tabaquismo entre otras como factor de riesgo. El tener en cuenta variantes ambientales permite a GrimAge mejorar a cualquier otro reloj epigenético a la hora de "predecir la muerte".[14] En los últimos años no han parado de desarrollarse nuevas herramientas de estimación de la edad, que además facilitan el pronóstico de ciertas enfermedades. Tanto es así que el Reloj de Zhang ha mejorado a todos los anteriores.[14] Relación con una causa de envejecimiento biológicoTodavía no se sabe qué mide exactamente la edad de metilación del ADN. Se desconocen los detalles pero Horvath planteó la hipótesis de que la edad de metilación del ADN mide el efecto acumulativo de un sistema de mantenimiento epigenético. El hecho de que la edad de la metilación del ADN en la sangre predice la mortalidad por todas las causas en la edad adulta[15][16][17][18] se ha utilizado para argumentar que se relaciona con un proceso que causa el envejecimiento.[19] Sin embargo, si una isla CpG en particular jugó un papel causal directo en el proceso de envejecimiento, la mortalidad que creó haría que fuera menos probable que se observara en personas mayores, haciendo que el sitio fuera menos propenso a ser elegido como predictor; las 353 islas CpG del reloj, por lo tanto, probablemente no tengan ningún efecto causal en absoluto.[20] Más bien, el reloj epigenético captura una propiedad emergente del epigenoma. Teoría del reloj epigenético del envejecimientoHorvath y Raj[21] propusieron una teoría del envejecimiento del reloj epigenético con los siguientes principios:
Motivación por los relojes biológicosEn general, se espera que los relojes biológicos del envejecimiento y los biomarcadores del envejecimiento tengan muchos usos en la investigación biológica, ya que la edad es una característica fundamental de la mayoría de los organismos. Las medidas precisas de la edad biológica (relojes de envejecimiento biológico) podrían ser útiles para
En general, se espera que los relojes biológicos sean útiles para estudiar qué causa el envejecimiento y qué se puede hacer contra él. Sin embargo, solo pueden capturar los efectos de las intervenciones que afectan la tasa de envejecimiento futuro, es decir, la pendiente de la curva de Gompertz por la cual la mortalidad aumenta con la edad, y no la de las intervenciones que actúan en un momento determinado, por ejemplo, para reducir la mortalidad en todas las edades, es decir, la intersección de la curva de Gompertz.[20] Propiedades del reloj de HorvathEl reloj se define como un método de estimación de la edad basado en 353 marcadores epigenéticos en el ADN. Los 353 marcadores miden la metilación del ADN de los dinucleótidos CpG. La edad estimada ("edad predicha" en el uso matemático), también conocida como edad de metilación del ADN, tiene las siguientes propiedades:
El crecimiento del organismo (y la división celular consiguiente) conduce a una alta tasa de tic-tac del reloj epigenético que se ralentiza a una tasa de tic-tac constante (dependencia lineal) después de la edad adulta (20 años). El hecho de que la edad de metilación del ADN de la sangre predice la mortalidad por toda causa en la vejez incluso después de ajustar por factores de riesgo conocidos es compatible con una variedad de relaciones causales. De manera similar, los marcadores de aptitud física y mental están asociados con el reloj epigenético (habilidades más bajas asociadas con la aceleración de la edad). Subestima sistemáticamente la edad de las personas mayores.[22] Las características sobresalientes del reloj epigenético de Horvath incluyen su aplicabilidad a un amplio espectro de tejidos y tipos de células. Dado que permite contrastar las edades de diferentes tejidos del mismo sujeto, puede usarse para identificar tejidos que muestran evidencia de una edad acelerada debido a una enfermedad. Estimadores genéticos en el reloj de HorvathEl reloj de Horvath, concretamente en su variante IEAA, se encuentra asociada con diferentes genes relacionados con el envejecimiento:[14] - TRIM59: de la familia de motivos tripartitos, asociado sólidamente con la edad cronológica y cuya expresión se ha observado en múltiples cánceres. - SMC4: inhibe la senescencia celular, un sello establecido en el envejecimiento. - KPNA4: miembro de la familia de importinas, receptores del transporte nuclear. La disfunción del transporte nuclear se ha propuesto como un marcador del envejecimiento. - CD46: codifica un regulador de la función de las células T y del sistema del complemento, componente clave del sistema inmunitario innato donde promueve la inflamación. - ATP8B4: codifica para una proteína transportadora de lípidos y contiene variantes que han sido reportadas en relación con la enfermedad del Alzheimer. - CXXC4: codifica Idax, inhibidor de la señalización Wnt. Enfoque estadísticoEl enfoque básico es formar un promedio ponderado de los 353 CpG de reloj, que luego se transforma en ADNm usando una función de calibración. La función de calibración revela que el reloj epigenético tiene una alta velocidad hasta la edad adulta, después de lo cual se desacelera a una frecuencia constante. Con los conjuntos de datos de entrenamiento, Horvath usó un modelo de regresión penalizado (regularización neta elástica) para hacer una regresión de una versión calibrada de la edad cronológica en 21,369 sondas CpG que estaban presentes tanto en la plataforma Illumina 450K como en la 27K y tenían menos de 10 valores faltantes. La edad del ADNm se define como la edad estimada ("predicha"). El predictor del modelo seleccionó automáticamente 353 CpG. 193 de los 353 CpG se correlacionan positivamente con la edad, mientras que los 160 CpG restantes se correlacionan negativamente con la edad. El software R y una herramienta basada en web disponible gratuitamente se pueden encontrar en la siguiente página web. ExactitudEl error medio de la edad estimada es de 3,6 años en un amplio espectro de tejidos y tipos de células, aunque esto aumenta en las personas mayores[22] El reloj epigenético funciona bien en tejidos heterogéneos (por ejemplo, sangre total, células mononucleares de sangre periférica, muestras cerebelosas, corteza occipital, epitelio bucal, colon, tejido adiposo, riñón, hígado, pulmón, saliva, cuello uterino, epidermis, músculo), así como en tipos de células individuales como células T CD4, monocitos CD14, células gliales, neuronas, células B inmortalizadas, células estromales mesenquimales. Sin embargo, la precisión depende en cierta medida de la fuente del ADN. Comparación con otros relojes biológicosEl reloj epigenético conduce a una predicción de la edad cronológica que tiene un coeficiente de correlación de Pearson de r = 0,96 con la edad cronológica (Figura 2 en ). Por lo tanto, la correlación de edad está cerca de su máximo valor de correlación posible, de 1. Otros relojes biológicos se basan en a) la longitud de los telómeros, b) los niveles de expresión de p16INK4a (también conocido como locus INK4a / ARF), y c) mutaciones de microsatélites .[23] La correlación entre la edad cronológica y la longitud de los telómeros es r = −0,51 en mujeres y r = −0,55 en hombres. La correlación entre la edad cronológica y los niveles de expresión de p16INK4a en células T es r = 0,56. p16INK4ap16INK4a solo se relacionan con la edad en las células T, un tipo de glóbulos blancos. Aplicaciones del reloj de HorvathAl contrastar la edad de metilación del ADN (edad estimada) con la edad cronológica, se pueden definir medidas de aceleración por edad. La aceleración de la edad se puede definir como la diferencia entre la edad de metilación del ADN y la edad cronológica. Alternativamente, se puede definir como el residuo que resulta de la regresión de la edad del ADN en la edad cronológica. La última medida es atractiva porque no se correlaciona con la edad cronológica. Un valor positivo / negativo de la aceleración de la edad epigenética sugiere que el tejido subyacente envejece más rápido / más lento de lo esperado. Estudios genéticos de la aceleración de la edad epigenéticaLa heredabilidad en sentido amplio (definida mediante la fórmula de Falconer) de la aceleración por la edad de la sangre de sujetos mayores es de alrededor del 40%, pero parece ser mucho mayor en los recién nacidos. De manera similar, se encontró que la aceleración por edad del tejido cerebral (corteza prefrontal) fue del 41% en sujetos mayores. Los estudios de asociación de todo el genoma (GWAS) de la aceleración de la edad epigenética en muestras de cerebro post mortem han identificado varios SNP (polimorfismo de nucleótido único) en un nivel de significancia de todo el genoma. Los GWAS de la aceleración de la edad en la sangre han identificado varios loci genéticos significativos en todo el genoma, incluido el locus del gen de la transcriptasa inversa de la telomerasa (TERT).[24] Las variantes genéticas asociadas con una mayor longitud de los telómeros de los leucocitos en el gen TERT confieren paradójicamente una mayor aceleración de la edad epigenética en la sangre. Factores de estilo de vidaEn general, los factores del estilo de vida solo tienen efectos débiles sobre la aceleración de la edad epigenética en la sangre.[25] Sin embargo, estudios transversales de las tasas de envejecimiento epigenético extrínseco en sangre confirman la sabiduría convencional sobre los beneficios de la educación, comer una dieta rica en plantas con carnes magras, el consumo moderado de alcohol, la actividad física y los riesgos asociados con el síndrome metabólico . Obesidad y síndrome metabólicoEl reloj epigenético se utilizó para estudiar la relación entre el índice de masa corporal (IMC) alto y las edades de metilación del ADN de la sangre, el hígado, los músculos y el tejido adiposo humanos. Se pudo observar una correlación significativa (r = 0,42) entre el IMC y la aceleración de la edad epigenética para el hígado. Un tamaño de muestra mucho mayor (n = 4200 muestras de sangre) reveló una correlación débil pero estadísticamente significativa (r = 0,09) entre el IMC y la aceleración intrínseca de la sangre por edad.[25] El mismo gran estudio encontró que varios biomarcadores del síndrome metabólico (niveles de glucosa, insulina, triglicéridos, proteína C reactiva, relación cintura-cadera) estaban asociados con la aceleración de la edad epigenética en la sangre. Por el contrario, los niveles altos de colesterol bueno HDL se asociaron con una menor tasa de envejecimiento epigenético de la sangre. El tejido mamario femenino es más antiguo de lo esperadoLa edad del ADN es mayor que la edad cronológica en el tejido mamario femenino adyacente al tejido del cáncer de mama. Dado que el tejido normal adyacente a otros tipos de cáncer no muestra un efecto similar de aceleración de la edad, este hallazgo sugiere que el tejido mamario femenino normal envejece más rápido que otras partes del cuerpo. De manera similar, se ha descubierto que las muestras de tejido mamario normal de mujeres sin cáncer son sustancialmente más antiguas que las muestras de sangre obtenidas de las mismas mujeres al mismo tiempo.[26] Cáncer de mama femeninoEn un estudio de tres relojes epigenéticos y el riesgo de cáncer de mama, se descubrió que la edad del ADN se aceleraba en muestras de sangre de mujeres sin cáncer, años antes del diagnóstico.[27] Tejido cancerosoLos tejidos cancerosos muestran efectos de aceleración de la edad tanto positivos como negativos. Para la mayoría de los tipos de tumores, no se puede observar una relación significativa entre la aceleración de la edad y la morfología del tumor (grado / estadio). En promedio, los tejidos cancerosos con TP53 mutado tienen una menor aceleración por edad que aquellos sin él. Además, los tejidos cancerosos con alta aceleración por edad tienden a tener menos mutaciones somáticas que aquellos con baja aceleración por edad. La aceleración de la edad está muy relacionada con diversas aberraciones genómicas en los tejidos cancerosos. Las mutaciones somáticas en los receptores de estrógeno o de progesterona se asocian con la edad acelerada del ADN en el cáncer de mama. Las muestras de cáncer colorrectal con una mutación BRAF (V600E) o hipermetilación del promotor del gen MLH1 de reparación de errores de apareamiento se asocian con una mayor aceleración de la edad. La aceleración de la edad en las muestras de glioblastoma multiforme se asocia de manera muy significativa con ciertas mutaciones en H3F3A . Un estudio sugiere que la edad epigenética del tejido sanguíneo puede ser un pronóstico de la incidencia de cáncer de pulmón.[28] Trisomía 21 (síndrome de Down)El síndrome de Down (SD) conlleva un mayor riesgo de muchas enfermedades crónicas que suelen estar asociadas con la vejez. Las manifestaciones clínicas del envejecimiento acelerado sugieren que la trisomía 21 aumenta la edad biológica de los tejidos, pero la evidencia molecular de esta hipótesis ha sido escasa. Según el reloj epigenético, la trisomía 21 aumenta significativamente la edad de la sangre y el tejido cerebral (en promedio 6,6 años). Neuropatología relacionada con la enfermedad de AlzheimerSe encontró que la aceleración de la edad epigenética de la corteza prefrontal humana se correlaciona con varias mediciones neuropatológicas que desempeñan un papel en la enfermedad de Alzheimer Además, se encontró que estaba asociada con una disminución en el funcionamiento cognitivo global y el funcionamiento de la memoria entre los individuos con Alzheimer. La edad epigenética de la sangre se relaciona con el funcionamiento cognitivo en los ancianos. En general, estos resultados sugieren fuertemente que el reloj epigenético se presta para medir la edad biológica del cerebro. El cerebelo envejece lentamenteHa sido difícil identificar tejidos que parecen evadir el envejecimiento debido a la falta de biomarcadores de la edad del tejido que permitan comparar las edades de diferentes tejidos. Una medición del reloj epigenético en 30 sitios anatómicos a seis centenarios y sujetos más jóvenes reveló que el cerebelo envejece lentamente: es aproximadamente 15 años más joven de lo esperado en un centenario. Este hallazgo podría explicar por qué el cerebelo presenta menos características neuropatológicas de demencias relacionadas con la edad en comparación con otras regiones del cerebro. En sujetos más jóvenes (por ejemplo, menores de 70 años), las regiones y las células del cerebro parecen tener aproximadamente la misma edad. Se han identificado varios SNP y genes que se relacionan con la edad epigenética del cerebelo. Enfermedad de HuntingtonSe ha descubierto que la enfermedad de Huntington aumenta las tasas de envejecimiento epigenético de varias regiones del cerebro humano.[29] Los centenarios envejecen lentamenteLa descendencia de semi-supercentenarios (sujetos que alcanzaron una edad de 105-109 años) tiene una edad epigenética más baja que los controles de la misma edad (diferencia de edad = 5.1 años en sangre) y los centenarios son más jóvenes (8.6 años) de lo esperado según su edad cronológica. Infección por VIHLa infección por el Virus de Inmunodeficiencia Humana-1 (VIH) está asociada con síntomas clínicos de envejecimiento acelerado, como lo demuestra la mayor incidencia y diversidad de enfermedades relacionadas con la edad a edades relativamente jóvenes. Pero ha sido difícil detectar un efecto de envejecimiento acelerado a nivel molecular. Un análisis de reloj epigenético del ADN humano de sujetos VIH + y controles detectó un efecto significativo de aceleración de la edad en el tejido cerebral (7,4 años) y sanguíneo (5,2 años) debido a la infección por VIH-1. Estos resultados son consistentes con un estudio independiente que también encontró un avance de 5 años en la sangre de pacientes con VIH y un fuerte efecto del locus HLA.[30] Enfermedad de ParkinsonUn estudio a gran escala sugiere que la sangre de sujetos con enfermedad de Parkinson, en concreto, su proporción de granulocitos[14], exhibe efectos de envejecimiento acelerado (relativamente débiles).[31] Trastorno del desarrollo: síndrome XLos niños con un trastorno muy raro conocido como síndrome X (no confundir con el síndrome metabólico) mantienen la fachada de rasgos persistentes similares a los de un niño pequeño mientras envejecen desde el nacimiento hasta la edad adulta. Dado que el desarrollo físico de estos niños se retrasa dramáticamente, estos niños parecen ser niños pequeños o, en el mejor de los casos, preescolares. Según un análisis del reloj epigenético, el tejido sanguíneo de los casos de síndrome X no es más joven de lo esperado. La menopausia acelera el envejecimiento epigenéticoLos siguientes resultados sugieren fuertemente que la pérdida de hormonas femeninas resultante de la menopausia acelera la tasa de envejecimiento epigenético de la sangre y posiblemente la de otros tejidos. En primer lugar, se ha descubierto que la menopausia precoz está asociada con una mayor aceleración de la sangre por edad epigenética. En segundo lugar, la menopausia quirúrgica (debida a ooforectomía bilateral) se asocia con una aceleración de la edad epigenética en sangre y saliva. En tercer lugar, la terapia hormonal de la menopausia, que mitiga la pérdida hormonal, se asocia con una aceleración negativa de las células bucales (pero no de las células sanguíneas) por la edad. En cuarto lugar, los marcadores genéticos que están asociados con la menopausia temprana también están asociados con una mayor aceleración de la edad epigenética en la sangre. Senescencia celular versus envejecimiento epigenéticoUn aspecto confuso del envejecimiento biológico es la naturaleza y el papel de las células senescentes. No está claro si los tres tipos principales de senescencia celular, a saber, la senescencia replicativa, la senescencia inducida por oncogenes y la senescencia inducida por daño del ADN son descripciones del mismo fenómeno provocado por diferentes fuentes, o si cada uno de ellos es distinto y cómo se asocian con envejecimiento epigenético. Se encontró que la inducción de la senescencia replicativa (RS) y la senescencia inducida por oncogenes (OIS) estaban acompañadas por el envejecimiento epigenético de las células primarias, pero la senescencia inducida por el daño del ADN no lo fue, a pesar de que RS y OIS activan la vía de respuesta al daño del ADN celular.[32] Estos resultados destacan la independencia de la senescencia celular del envejecimiento epigenético. De acuerdo con esto, las células inmortalizadas con telomerasa continuaron envejeciendo (de acuerdo con el reloj epigenético) sin haber sido tratadas con ningún inductor de senescencia o agentes que dañen el ADN, reafirmando la independencia del proceso de envejecimiento epigenético de los telómeros, la senescencia celular y la vía de respuesta al daño del ADN. Aunque el desacoplamiento de la senescencia del envejecimiento celular parece a primera vista ser inconsistente con el hecho de que las células senescentes contribuyen a la manifestación física del envejecimiento del organismo, como lo demostraron Baker et al., Donde la eliminación de las células senescentes ralentizó el envejecimiento.[33] Sin embargo, el análisis del reloj epigenético de la senescencia sugiere que la senescencia celular es un estado al que las células se ven obligadas a entrar como resultado de presiones externas como el daño del ADN, la expresión de oncogenes ectópicos y la proliferación exhaustiva de células para reponer las eliminadas por factores externos / ambientales. Estas células senescentes, en cantidad suficiente, probablemente provocarán el deterioro de los tejidos, lo que se interpreta como envejecimiento del organismo. Sin embargo, a nivel celular, el envejecimiento, medido por el reloj epigenético, es distinto de la senescencia. Es un mecanismo intrínseco que existe desde el nacimiento de la célula y continúa. Esto implica que si las presiones externas descritas anteriormente no desvían a las células a la senescencia, seguirán envejeciendo. Esto es consistente con el hecho de que los ratones con telómeros naturalmente largos aún envejecen y en algún momento mueren a pesar de que la longitud de sus telómeros es mucho más larga que el límite crítico, y envejecen prematuramente cuando sus telómeros se acortan a la fuerza, debido a la senescencia replicativa. Por tanto, la senescencia celular es una ruta por la cual las células salen prematuramente del curso natural del envejecimiento celular. Efecto del sexo y la raza / etniaLos hombres envejecen más rápido que las mujeres según la aceleración de la edad epigenética en la sangre, el cerebro, la saliva y muchos otros tejidos.[34] El método del reloj epigenético se aplica a todos los grupos raciales / étnicos examinados en el sentido de que la edad del ADN está altamente correlacionada con la edad cronológica. Pero la etnia puede asociarse con la aceleración de la edad epigenética. Por ejemplo, la sangre de los hispanos y los tsimané envejece más lentamente que la de otras poblaciones, lo que podría explicar la paradoja de la mortalidad hispana. Efecto rejuvenecedor debido al trasplante de células madre en sangreEl trasplante de células madre hematopoyéticas, que trasplanta estas células de un donante joven a un receptor mayor, rejuvenece la edad epigenética de la sangre a la del donante. Sin embargo, la enfermedad de injerto contra huésped se asocia con una mayor edad de metilación del ADN.[35] ProgeriaLa progeria adulta, también conocida como síndrome de Werner, está asociada con la aceleración de la edad epigenética en la sangre. Las muestras de fibroblasto de niños con progeria Hutchinson-Gilford exhiben efectos de envejecimiento epigenético acelerado de acuerdo con el reloj epigenético de "piel y sangre", pero no de acuerdo con el reloj de tejido de pan original de Horvath.[36] Reloj de GrimAge.El reloj GrimAge se define como un método estimador de la edad basado en la metilación del ADN junto con otros parámetros como la edad, el sexo, los niveles de factor de diferenciación del crecimiento 15, la activación del inhibidor de plasminógeno 1, o la variante del tabaquismo.[14] En estudios de GWAS realizados utilizando este estimador, se obtuvo que la aceleración de GrimAge está relacionada con un mayor nivel de adiposidad mediante el índice de masa corporal, la circunferencia de las caderas y la circunferencia de la cintura.[14] El estudio de individuos fumadores además, mostró evidencias de un efecto causal de aceleración incrementada en GrimAge. Por el contrario, un estudio en exfumadores mostró evidencias de un efecto causal inverso, indicando que la aceleración de GrimAge se reducía cuando cesaba la actividad fumadora.[14] Otro de los factores más curiosos relacionados con la aceleración de GrimAge es el nivel educativo, el cual se ha mostrado inversamente proporcional a la aceleración de la edad en ciertos estudios.[14] Mecanismo biológico detrás del reloj epigenético.A pesar de que los biomarcadores del envejecimiento basados en datos de metilación del ADN han permitido estimaciones precisas de la edad de cualquier tejido a lo largo de todo el ciclo de vida, actualmente se desconoce el mecanismo biológico preciso detrás del reloj epigenético.[21] Sin embargo, los biomarcadores epigenéticos pueden ayudar a abordar preguntas de larga data en muchos campos, incluida la pregunta central: ¿por qué envejecemos? Para comprender la esencia de los mecanismos detrás del reloj epigenético, sería aconsejable hacer una comparación y encontrar la relación entre las lecturas del reloj epigenético y el reloj de envejecimiento del transcriptoma[37] Las siguientes explicaciones se han propuesto por ahora en la literatura. Posible explicación 1: Sistema de mantenimiento epigenómicoHorvath planteó la hipótesis de que su reloj surge de una huella de metilación dejada por un sistema de mantenimiento epigenómico. Posible explicación 2: daños en el ADN no reparadosLos daños al ADN endógeno ocurren con frecuencia, incluyendo alrededor de 50 roturas de ADN de doble cadena por ciclo celular[38] y alrededor de 10,000 daños oxidativos por día (ver daño del ADN (que ocurre naturalmente)). Durante la reparación de roturas de doble hebra se introducen muchas alteraciones epigenéticas y, en un porcentaje de los casos, las alteraciones epigenéticas permanecen después de que se completa la reparación, incluida la metilación aumentada de los promotores de islas CpG.[39][40][41] Recientemente se encontraron alteraciones epigenéticas similares, pero generalmente transitorias, durante la reparación de daños oxidativos causados por H 2 O 2, y se sugirió que ocasionalmente estas alteraciones epigenéticas también pueden permanecer después de la reparación.[42] Estas alteraciones epigenéticas acumuladas pueden contribuir al reloj epigenético. La acumulación de alteraciones epigenéticas puede ser paralela a la acumulación de daños en el ADN no reparados que, según se propone, causan envejecimiento (consulte la teoría del envejecimiento del daño al ADN ). Otros estimadores de edad basados en niveles de metilación del ADNEn la literatura se han descrito varios otros estimadores de edad. 1) Weidner et al. (2014) describen un estimador de edad para el ADN de la sangre que usa solo tres sitios CpG de genes apenas afectados por el envejecimiento (cg25809905 en integrina, alfa 2b (ITGA2B); cg02228185 en aspartoacilasa (ASPA) y cg17861230 en fosfodiesterasa 4C, cAMP específico (PDE4C )). El estimador de edad de Weidener et al. (2014) se aplica solo a la sangre. Incluso en sangre, este estimador escaso es mucho menos preciso que el reloj epigenético de Horvath (Horvath 2014) cuando se aplica a los datos generados por las plataformas Illumina 27K o 450K.[43] Pero el estimador disperso se desarrolló para datos de pirosecuenciación y es económicamente muy rentable.[44] 2) Hannum y col. (2013) reportan varios estimadores de edad: uno para cada tipo de tejido. Cada uno de estos estimadores requiere información de covariables (por ejemplo, sexo, índice de masa corporal, lote). Los autores mencionan que cada tejido condujo a un claro desplazamiento lineal (intersección y pendiente). Por lo tanto, los autores tuvieron que ajustar el estimador de edad en sangre para cada tipo de tejido utilizando un modelo lineal. Cuando el estimador de Hannum se aplica a otros tejidos, conduce a un alto error (debido a una mala calibración) como puede verse en la Figura 4A en Hannum et al. (2013). Hannum y col. ajustó su estimador de edad basado en sangre (ajustando la pendiente y el término de intersección) para aplicarlo a otros tipos de tejido. Dado que este paso de ajuste elimina las diferencias entre los tejidos, el estimador basado en sangre de Hannum et al. no se puede utilizar para comparar las edades de diferentes tejidos / órganos. Por el contrario, una característica destacada del reloj epigenético es que no es necesario realizar dicho paso de calibración: siempre utiliza los mismos CpG y los mismos valores de coeficiente. Por lo tanto, el reloj epigenético de Horvath se puede utilizar para comparar las edades de diferentes tejidos / células / órganos del mismo individuo. Mientras que los estimadores de edad de Hannum et al. no se pueden usar para comparar las edades de diferentes tejidos normales, se pueden usar para comparar la edad de un tejido canceroso con la de un tejido normal (no canceroso) correspondiente. Hannum y col. informaron efectos pronunciados de aceleración de la edad en todos los cánceres. Por el contrario, el reloj epigenético de Horvath[45] revela que algunos tipos de cáncer (p. Ej. Cánceres de mama triple negativo o carcinoma endometrial del cuerpo uterino) presentan una aceleración negativa de la edad, es decir, el tejido canceroso puede ser mucho más joven de lo esperado. Una diferencia importante se relaciona con covariables adicionales. Los estimadores de edad de Hannum utilizan covariables como sexo, índice de masa corporal, estado de diabetes, etnia y lote. Dado que los datos nuevos involucran lotes diferentes, no se pueden aplicar directamente a los datos nuevos. Sin embargo, los autores presentan valores de coeficientes para sus CpG en tablas complementarias que se pueden usar para definir una medida agregada que tiende a estar fuertemente correlacionada con la edad cronológica pero que puede estar mal calibrada (es decir, dar lugar a errores elevados). 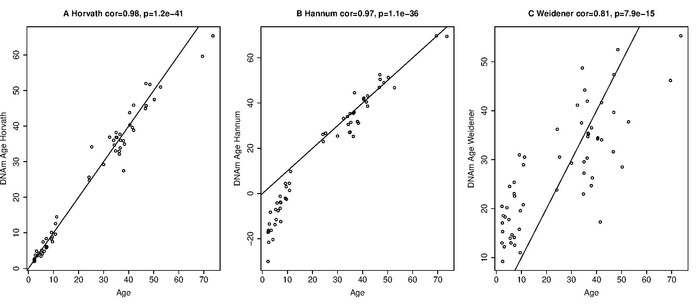 3. ) Giuliani y col. Identificar regiones genómicas cuyo nivel de metilación del ADN se correlacione con la edad en los dientes humanos. Proponen la evaluación de la metilación del ADN en los genes ELOVL2, FHL2 y PENK en el ADN recuperado tanto del cemento como de la pulpa de los mismos dientes modernos.[46] Quieren aplicar este método también a dientes humanos históricos y relativamente antiguos. En un estudio de evaluación comparativa multicéntrico, 18 grupos de investigación de tres continentes compararon todos los métodos prometedores para analizar la metilación del ADN en la clínica e identificaron los métodos más precisos, habiendo concluido que las pruebas epigenéticas basadas en la metilación del ADN son una tecnología madura lista para un amplio uso clínico.[47] 4) McCartney y col. El inhibidor del activador del plasminógeno 1 (PAI1) también puede utilizarse como estimador de la edad relacionado con los niveles de metilación del ADN, pues se ha visto que muestra asociaciones más fuertes con la enfermedad cardiometabólica que algunos relojes epigenéticos.[14] Otras especiesWang et al., (en hígados de ratones)[48] y Petkovich et al., (Basados en perfiles de metilación del ADN en sangre de ratones)[49] examinaron si los ratones y los humanos experimentan patrones similares de cambio en el metiloma con la edad. Descubrieron que los ratones tratados con intervenciones que prolongan la vida útil (como la restricción de calorías o la rapamicina en la dieta) eran significativamente más jóvenes en edad epigenética que sus del grupo de control (no tratados) de tipo salvaje de la misma edad. Predictores de la edad en ratones también detectan los efectos longevidad de knockouts de genes, y el rejuvenecimiento de fibroblastos derivados de iPSCs. El predictor de edad de múltiples tejidos en ratones basado en la metilación del ADN en 329 sitios CpG únicos alcanzó un error absoluto medio de menos de cuatro semanas (~ 5 por ciento de la vida). Un intento de utilizar los mismos sitios del reloj humano en ratones para predercir la edad mostró que el reloj humano no se conserva completamente en los ratones.[50] Las diferencias entre los relojes de humanos y el de los ratones sugieren que los relojes epigenéticos deben entrenarse específicamente para diferentes especies.[51] Los cambios en los patrones de metilación del ADN tienen un gran potencial para la estimación de la edad y la búsqueda de biomarcadores en animales domésticos y salvajes.[52] Referencias
Bibliografía adicional
|