|
GS-CA1 |
|---|
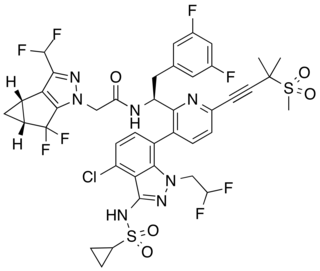 | | Nombre IUPAC |
|---|
|
N-((S)-1-(3-(4-chloro-3-(cyclopropanesulfonamido)-1-(2,2-difluoroethyl)-1H-indazol-7-yl)-6-(3-methyl-3-(methylsulfonyl)but-1-yn-1-yl)pyridin-2-yl)-2-(3,5-difluorophenyl)ethyl)-2-((3bS,4aR)-3-(difluoromethyl)-5,5-difluoro-3b,4,4a,5-tetrahydro-1H-cyclopropa | | General |
|---|
| Fórmula estructural |
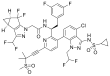 |
|---|
| Fórmula molecular |
C41H36ClF8N7O5S2 |
|---|
| Identificadores |
|---|
| PubChem |
134262970 |
|---|
InChI= InChI=1S/C41H36ClF8N7O5S2/c1-40(2,63(3,59)60)11-10-22-4-7-24(25-8-9-28(42)33-36(25)56(17-30(45)46)54-39(33)55-64(61,62)23-5-6-23)34(51-22)29(14-19-12-20(43)15-21(44)13-19)52-31(58)18-57-37-32(35(53-57)38(47)48)26-16-27(26)41(37,49)50/h4,7-9,12-13,15,23,26-27,29-30,38H,5-6,14,16-18H2,1-3H3,(H,52,58)(H,54,55)/t26-,27+,29-/m0/s1Key: CPCUUUACFKQOHY-GKRYNVPLSA-N | | Propiedades físicas |
|---|
| Masa molar |
958,34 g/mol |
|---|
Valores en el SI y en condiciones estándar
(25 ℃ y 1 atm), salvo que se indique lo contrario. | |
El GS-CA1 es una molécula inhibidora de la cápside del virus de inmunodeficiencia humana (VIH)[1] presentada por primera vez en 2017. Su función es inhibir el proceso de replicación, tanto en su fase inicial como final, evitando así, la maduración del virus. Hasta el momento, se han descubierto varias moléculas cuya función es la misma que la del GS-CA1, pero en comparación a estos inhibidores de la cápside del VIH, éste tiene mucha más potencia inhibidora y su efecto es más duradero.
A pesar de los recientes resultados, el GS-CA1 está siendo investigado, ya que aún hay muchos datos que la comunidad científica desconoce.[2] Aún no se ha utilizado para ningún tratamiento clínico pero se prevé que será un elemento importante para la cura del VIH.
Descubrimiento
En febrero del 2017, durante la Conferencia sobre Retrovirus e Infecciones Oportunistas (CROI por sus siglas en inglés Conference on Retrovirus and Opportunistic Infections) realizada en Seattle (USA), la molécula GS-CA 1 fue presentada por primera vez por el científico Winston C. Tse. Él llevaba una década investigando la cápside del VIH para encontrar una molécula que fuera capaz de inhibir el proceso de replicación. Trabajando en conjunto con otros científicos de la compañía Gilead Sciences pudo sintetizar y estudiar las propiedades inhibidoras del GS-CA1.[3] La solubilidad de la molécula es muy baja debido a que los anillos de carbono que la forman son estructuras hidrofóbicas o apolares.
Inhibición de la cápside
Estructura de la cápside
Para entender la función inhibidora del GS-CA1 es necesario conocer la estructura de la cápside[4] y cómo actúa el GS-CA1 en ella. En el VIH, esta estructura es muy importante,[5] ya que es desde ahí donde se realiza el ensamblaje y la maduración de las partículas de la infección viral que están medidas por la interacción de la cápside.[6]
Por otra parte, es necesario conocer la estructura de la cápside del VIH para entender cómo GS-CA 1 la inhibe. La cápside del VIH es un núcleo de proteínas cerrado compuesta por una red polimérica (250 hexámeros[7] y 12 pentámeros) de la proteína CA. Esta proteína tiene 2 dominios, el N-terminal (CA-NTD) y el C-terminal (CA-CTD) los cuales están enlazados por una cadena peptídica formada por 5 aminoácidos.[8] Para la formación de los hexámeros y pentámeros, la proteína CA se oligomeriza en trímeros de dímeros.[9] Los dímeros de CA son asociados durante el proceso de montaje para formar la estructura final de la cápside.[10] Es en esta unión donde la GS-CA1 actúa para inhibir al virus. La GS-CA1 se une en puntos específicos entre estos espacios para catalizar la formación de cápside, provocando malformaciones[11] que impedirán el proceso de replicación e infección.[12]
El rol principal de los inhibidores de la cápside es perturbar los oligómeros de la CA.[13] Los inhibidores de la cápside tienen múltiples modos de acción aumentando la población de cápsides maduras que fallan al encerrar el RNA viral durante la maduración o que espontáneamente se desmontan antes del transporte y la integración nuclear.
La secuencia de la cápside es altamente conservada[14] y eso reduce la probabilidad de pleoformismo viral, proceso por el cual, la construcción de la cápside se puede hacer por otras vías alternativas que hasta pueden llegar a cambiar su estructura.[1]
Función inhibidora del GS-CA1 en el ciclo viral
En cuanto al mecanismo de acción, el GS-CA1 se une directamente a la cápside del virus e interfiere en la importación nuclear de ADN viral mediada por la cápside, la producción de los viriones y el ensamblaje de la cápside.[15] El GS-CA1 en concentraciones picomolares es un inhibidor tanto de la etapa temprana como de la etapa tardía del ciclo reproductivo del VIH-1.
En la etapa temprana de la infección por VIH-1, el GS-CA1 presenta diferentes consecuencias según su concentración. A una concentración de 25 nM (500 veces la EC50), GS-CA1 se comporta de manera similar al efavirenz,[16] de manera que el GS-CA1 puede interferir en transcripción inversa cuando se encuentra en altas concentraciones. Las concentraciones intermedias de GS-CA1 (5 nM; 100 veces mayor que EC50) no tienen ningún efecto en la síntesis total de ADNc de VIH, sin embargo, reducen considerablemente la formación de provirus integrados, lo que nos indica que GS-CA1 puede prevenir la importación nuclear de ADNc viral. Con la concentración más baja (0,5 nM; 10 veces superior a EC50), GS-CA1 interfiere en la entrada nuclear y la integración sin afectar el ADNc viral. Mostrando que en presencia de GS-CA1 la mayor parte de la concentración de vDNA y las señales de la cápside se encuentra en el citoplasma se ha llegado a la conclusión que el GS-CA1 inhibe la fase temprana de la infección viral al bloquear la translocación dependiente de la cápside del ADNc de VIH-1 en el núcleo, impidiendo de esta manera la infección.
En cuanto a las etapas finales de la replicación viral, GS-CA1 es capaz de interferir en el correcto ensamblaje de CA en cápsides cónicas de los viriones liberados.[17] GS-CA1 provoca la formación de polímeros de CA cortos, con malformaciones y heterogéneos en contraposición a los uniformes, largos y bien organizados observados en ausencia de GS-CA1. Lo cual nos indica la capacidad del GS-CA1 para interferir en la formación de la cápside. También se ha demostrado que el GS-CA1 es capaz de reducir los niveles celulares de Gag y CA.[18] La causa es que el GS-CA1 se puede unir al Gag/Gag-Pol provocando problemas en estas poliproteínas precursoras[19] de CA. GS-CA1 limita por tanto la producción y el ensamblaje adecuado de partículas de virus afectando la producción de CA. De esta manera GS-CA1 es capaz de interferir tanto en la etapa temprana como en la tardía característica única entre todas las clases de ARV aprobadas actualmente.[20]
También se ha determinado el lugar de unión del GS-CA1 a la VIH CA, (unión saturable y dependiente de la dosis) a todas las regiones de la CA exceptuando el dominio C-terminal.[2]
Eficacia
La GS-CA1, es un potente inhibidor de la replicación en células T CD4+ infectadas de VIH-1 que muestra una potencia similar o superior contra múltiples VIH clínicos de la mayoría de clados en las células mononucleares de sangre periférica (como los monocitos o linfocitos).[1]
El GS-CA1 muestra gran estabilidad metabólica in vitro y perfiles pK favorables en múltiples especies preclínicas con un sistema de limpieza de medicamentos bajo (entre 0,08 a 0,33 Litros limpios por cada hora por cada kg del cuerpo del organismo modelo) y con vidas medias largas (7,2 a 18,7 horas). De esta manera, El GS-CA1 se presenta como una molécula pequeña, inhibidora de la cápside del VIH extremadamente potente, capaz de ser administrada de manera sostenida gracias a su alta potencia y estabilidad metabólica. A diferencia de otros antirretrovirales[21] también de acción prolongada, la administración del GS-CA1 no requiere grandes dosis que puedan causar molestias[22] y posibilita la administración subcutánea.[23] Presentándose este fármaco como una opción de larga duración, eficaz contra variantes resistentes y fácilmente administrable.[24]
En células T infectadas con VIH-1, GS-CA1 mostró una alta potencia antiviral, con una media de concentración efectiva al 50% de 240 +-40 pM, baja citotoxicidad y alto índice de selectividad (relación entre la concentración citotóxica y la concentración efectiva). Su alta estabilidad metabólica y baja solubilidad permitió la fabricación de un medicamento en ratones siguiendo un simple dosis subcutánea. GS-CA1 mostró su alta eficacia antiviral como una monoterapia inyectable de larga duración en ratones modelos humanizados de la infección del VIH-1, siendo más eficaz que el medicamento de larga duración rilpivirina.[25]
Comparación de los otros inhibidores (CAIs)
Al ser una molécula nueva, se debe comparar el potencial que tiene como futuro fármaco. El GS-CA1 tiene un nivel de eficacia muy elevado si lo comparamos con otros inhibidores de la proteína CA de la cápside del VIH. A continuación, una tabla que compara las concentraciones eficaces al 50% de cada inhibidor:[26]
| Inhibidor de la cápside
|
Ec 50%*
|
| GS-CA1 |
240+-40 pM
|
| PF74[27] |
80-640 nM
|
| Bevirimat (BVM) |
4,5-20,1 nM
|
| Benzodiazepina (BD1) |
70+-30 nM
|
*Las EC 50% (concentraciones efectivas al 50%) son la mitad de la concentración a la que el inhibidor induce una respuesta al 100% de las células infectadas
Cabe destacar que los inhibidores de CA identificados en la tabla mantienen su actividad completa en contra de los VIH-1 mutantes resistentes a las terapias antirretrovirales que se usan actualmente.
Resistencia al GS-CA1
El virus de la inmunodeficiencia humana presenta mutaciones en la proteína de la cápside (CA) que le hacen resistente a la inhibición del GS-CA1. Estas mutaciones son: L56I, M66I, Q67H, N74D y A105E.[28] Se considera que estos cambios en los aminoácidos evitan la unión de la molécula GS-CA1 a la proteína CA, por lo que se podría formar con éxito la cápside y así madurar.[2]
Sin embargo, las mutaciones de la proteína CA que le hacen inmunes al GS-CA1 disminuyen considerablemente, en la mayoría de casos, su tasa de infectividad:
| Mutación resistente al GS-CA1
|
L56I
|
M66I
|
Q67H
|
N74D
|
A105E
|
| Infectividad (en comparación a VIH sin estas mutaciones)
|
9%
|
6%
|
98%
|
48%
|
10%
|
Investigación actual
El GS-CA1 está siendo investigado por la comunidad científica con el objetivo de conocer nuevos datos sobre su funcionamiento y su posible utilidad en los tratamientos clínicos, ya que aún no se ha utilizado para ello.
No obstante, sí ha sido utilizado en investigaciones con ratas humanizadas donde se ha demostrado su capacidad de inhibición del HIV y su alto potencial en células T y células mononucleares de sangre periférica .[24]
Por otro lado, el GS-6207, una molécula muy parecida al GS-CA1, ha sido presentada como el primer inhibidor de cápside HIV en entrar en ensayos clínicos y actualmente se encuentra en fase 1a/1b de estudios de prueba de concepto para determinar el perfil de seguridad, la dosis óptima y la frecuencia de la administración.[29]
Todo hace pensar que el GS-CA1 será una molécula muy importante y presente en los tratamientos contra el VIH.
Referencias
- ↑ a b c Carnes, Stephanie; Sheehan, Jonathan; Aiken, Christopher (2018-7). «Inhibitors of the HIV-1 capsid, a target of opportunity». Current Opinion in Hiv and Aids (en inglés) 13 (4): 359-365. ISSN 1746-630X. PMC 6075716. PMID 29782334. doi:10.1097/COH.0000000000000472. Consultado el 23 de octubre de 2019.
- ↑ a b c Yant, Stephen R.; Mulato, Andrew; Hansen, Derek; Tse, Winston C.; Niedziela-Majka, Anita; Zhang, Jennifer R.; Stepan, George J.; Jin, Debi et al. (2019-09). «A highly potent long-acting small-molecule HIV-1 capsid inhibitor with efficacy in a humanized mouse model». Nature Medicine (en inglés) 25 (9): 1377-1384. ISSN 1546-170X. doi:10.1038/s41591-019-0560-x. Consultado el 24 de octubre de 2019.
- ↑ «DISCOVERY OF NOVEL POTENT HIV CAPSID INHIBITORS WITH LONG-ACTING POTENTIAL | CROI Conference». www.croiconference.org. Consultado el 23 de octubre de 2019.
- ↑ Blair, Wade S.; Pickford, Chris; Irving, Stephen L.; Brown, David G.; Anderson, Marie; Bazin, Richard; Cao, Joan; Ciaramella, Giuseppe et al. (9 de diciembre de 2010). «HIV Capsid is a Tractable Target for Small Molecule Therapeutic Intervention». En Luban, Jeremy, ed. PLoS Pathogens (en inglés) 6 (12): e1001220. ISSN 1553-7374. PMC 3000358. PMID 21170360. doi:10.1371/journal.ppat.1001220. Consultado el 24 de octubre de 2019.
- ↑ Gres, Anna T.; Kirby, Karen A.; KewalRamani, Vineet N.; Tanner, John J.; Pornillos, Owen; Sarafianos, Stefan G. (3 de julio de 2015). «X-ray crystal structures of native HIV-1 capsid protein reveal conformational variability». Science (en inglés) 349 (6243): 99-103. ISSN 0036-8075. PMC 4584149. PMID 26044298. doi:10.1126/science.aaa5936. Consultado el 26 de octubre de 2019.
- ↑ Sundquist, W. I.; Krausslich, H.-G. (1 de agosto de 2012). «HIV-1 Assembly, Budding, and Maturation». Cold Spring Harbor Perspectives in Medicine (en inglés) 2 (8): a015420-a015420. ISSN 2157-1422. PMC 3405834. doi:10.1101/cshperspect.a015420. Consultado el 24 de octubre de 2019.
- ↑ Pornillos, Owen; Ganser-Pornillos, Barbie K.; Kelly, Brian N.; Hua, Yuanzi; Whitby, Frank G.; Stout, C. David; Sundquist, Wesley I.; Hill, Christopher P. et al. (2009-6). «X-Ray Structures of the Hexameric Building Block of the HIV Capsid». Cell (en inglés) 137 (7): 1282-1292. PMC 2840706. PMID 19523676. doi:10.1016/j.cell.2009.04.063. Consultado el 25 de octubre de 2019.
- ↑ Machara, Aleš; Lux, Vanda; Kožíšek, Milan; Grantz Šašková, Klára; Štěpánek, Ondřej; Kotora, Martin; Parkan, Kamil; Pávová, Marcela et al. (28 de enero de 2016). «Specific Inhibitors of HIV Capsid Assembly Binding to the C-Terminal Domain of the Capsid Protein: Evaluation of 2-Arylquinazolines as Potential Antiviral Compounds». Journal of Medicinal Chemistry (en inglés) 59 (2): 545-558. ISSN 0022-2623. doi:10.1021/acs.jmedchem.5b01089. Consultado el 24 de octubre de 2019.
- ↑ Tsiang, Manuel; Niedziela-Majka, Anita; Hung, Magdeleine; Jin, Debi; Hu, Eric; Yant, Stephen; Samuel, Dharmaraj; Liu, Xiaohong et al. (5 de junio de 2012). «A Trimer of Dimers Is the Basic Building Block for Human Immunodeficiency Virus-1 Capsid Assembly». Biochemistry 51 (22): 4416-4428. ISSN 0006-2960. doi:10.1021/bi300052h. Consultado el 23 de octubre de 2019.
- ↑ Schur, Florian K. M.; Obr, Martin; Hagen, Wim J. H.; Wan, William; Jakobi, Arjen J.; Kirkpatrick, Joanna M.; Sachse, Carsten; Kräusslich, Hans-Georg et al. (29 de julio de 2016). «An atomic model of HIV-1 capsid-SP1 reveals structures regulating assembly and maturation». Science (en inglés) 353 (6298): 506-508. ISSN 0036-8075. doi:10.1126/science.aaf9620. Consultado el 24 de octubre de 2019.
- ↑ Mattei, Simone; Glass, Bärbel; Hagen, Wim J. H.; Kräusslich, Hans-Georg; Briggs, John A. G. (16 de diciembre de 2016). «The structure and flexibility of conical HIV-1 capsids determined within intact virions». Science (en inglés) 354 (6318): 1434-1437. ISSN 0036-8075. doi:10.1126/science.aah4972. Consultado el 26 de octubre de 2019.
- ↑ Pak, Alexander J.; Grime, John M. A.; Yu, Alvin; Voth, Gregory A. (3 de julio de 2019). «Off-Pathway Assembly: A Broad-Spectrum Mechanism of Action for Drugs That Undermine Controlled HIV-1 Viral Capsid Formation». Journal of the American Chemical Society (en inglés) 141 (26): 10214-10224. ISSN 0002-7863. PMC 6739737. PMID 31244184. doi:10.1021/jacs.9b01413. Consultado el 24 de octubre de 2019.
- ↑ Forshey, Brett M.; von Schwedler, Uta; Sundquist, Wesley I.; Aiken, Christopher (2002-6). «Formation of a human immunodeficiency virus type 1 core of optimal stability is crucial for viral replication». Journal of Virology 76 (11): 5667-5677. ISSN 0022-538X. PMC 137032. PMID 11991995. doi:10.1128/jvi.76.11.5667-5677.2002. Consultado el 25 de octubre de 2019.
- ↑ Rihn, Suzannah J.; Wilson, Sam J.; Loman, Nick J.; Alim, Mudathir; Bakker, Saskia E.; Bhella, David; Gifford, Robert J.; Rixon, Frazer J. et al. (20 de junio de 2013). «Extreme Genetic Fragility of the HIV-1 Capsid». En Luban, Jeremy, ed. PLoS Pathogens (en inglés) 9 (6): e1003461. ISSN 1553-7374. PMC 3688543. PMID 23818857. doi:10.1371/journal.ppat.1003461. Consultado el 26 de octubre de 2019.
- ↑ Ehrlich, L. S.; Agresta, B. E.; Carter, C. A. (1992-8). «Assembly of recombinant human immunodeficiency virus type 1 capsid protein in vitro». Journal of Virology 66 (8): 4874-4883. ISSN 0022-538X. PMC 241323. PMID 1629958. Consultado el 25 de octubre de 2019.
- ↑ Hammer, Scott M.; Eron, Joseph J.; Reiss, Peter; Schooley, Robert T.; Thompson, Melanie A.; Walmsley, Sharon; Cahn, Pedro; Fischl, Margaret A. et al. (6 de agosto de 2008). «Antiretroviral treatment of adult HIV infection: 2008 recommendations of the International AIDS Society-USA panel». JAMA 300 (5): 555-570. ISSN 1538-3598. PMID 18677028. doi:10.1001/jama.300.5.555. Consultado el 24 de octubre de 2019.
- ↑ Ganser, B. K. (1 de enero de 1999). «Assembly and Analysis of Conical Models for the HIV-1 Core». Science 283 (5398): 80-83. doi:10.1126/science.283.5398.80. Consultado el 26 de octubre de 2019.
- ↑ Vogt, Volker M. (2005-8). «Blocking HIV-1 virus assembly». Nature Structural & Molecular Biology 12 (8): 638-639. ISSN 1545-9993. PMID 16077724. doi:10.1038/nsmb0805-638. Consultado el 24 de octubre de 2019.
- ↑ Li, Guangdi; Verheyen, Jens; Rhee, Soo-Yon; Voet, Arnout; Vandamme, Anne-Mieke; Theys, Kristof (2013). «Functional conservation of HIV-1 Gag: implications for rational drug design». Retrovirology (en inglés) 10 (1): 126. ISSN 1742-4690. PMC 4228425. PMID 24176092. doi:10.1186/1742-4690-10-126. Consultado el 26 de octubre de 2019.
- ↑ Pak, Alexander J.; Grime, John M. A.; Yu, Alvin; Voth, Gregory A. (3 de julio de 2019). «Off-Pathway Assembly: A Broad-Spectrum Mechanism of Action for Drugs That Undermine Controlled HIV-1 Viral Capsid Formation». Journal of the American Chemical Society 141 (26): 10214-10224. ISSN 1520-5126. PMC 6739737. PMID 31244184. doi:10.1021/jacs.9b01413. Consultado el 24 de octubre de 2019.
- ↑ De Clercq, Erik (2010-10). «Antiretroviral drugs». Current Opinion in Pharmacology (en inglés) 10 (5): 507-515. doi:10.1016/j.coph.2010.04.011. Consultado el 26 de octubre de 2019.
- ↑ Claborn, Kasey R.; Meier, Ellen; Miller, Mary Beth; Leffingwell, Thad R. (3 de abril de 2015). «A systematic review of treatment fatigue among HIV-infected patients prescribed antiretroviral therapy». Psychology, Health & Medicine (en inglés) 20 (3): 255-265. ISSN 1354-8506. PMC 4315727. PMID 25110152. doi:10.1080/13548506.2014.945601. Consultado el 26 de octubre de 2019.
- ↑ Nyaku, Amesika N; Kelly, Sean G; Taiwo, Babafemi O (2017-4). «Long-Acting Antiretrovirals: Where Are We now?». Current HIV/AIDS Reports (en inglés) 14 (2): 63-71. ISSN 1548-3568. doi:10.1007/s11904-017-0353-0. Consultado el 26 de octubre de 2019.
- ↑ a b Singh, Kamal; Gallazzi, Fabio; Hill, Kyle J.; Burke, Donald H.; Lange, Margaret J.; Quinn, Thomas P.; Neogi, Ujjwal; Sönnerborg, Anders (20 de junio de 2019). «GS-CA Compounds: First-In-Class HIV-1 Capsid Inhibitors Covering Multiple Grounds». Frontiers in Microbiology 10: 1227. ISSN 1664-302X. PMC 6613529. PMID 31312185. doi:10.3389/fmicb.2019.01227. Consultado el 23 de octubre de 2019.
- ↑ Ferretti, Francesca; Boffito, Marta (2018-7). «Rilpivirine long-acting for the prevention and treatment of HIV infection:». Current Opinion in HIV and AIDS (en inglés) 13 (4): 300-307. ISSN 1746-630X. doi:10.1097/COH.0000000000000474. Consultado el 25 de octubre de 2019.
- ↑ Thenin-Houssier, Suzie; Valente, Susana T. (2016). «HIV-1 Capsid Inhibitors as Antiretroviral Agents». Current HIV research 14 (3): 270-282. ISSN 1873-4251. PMC 4785820. PMID 26957201. Consultado el 23 de octubre de 2019.
- ↑ Balasubramaniam, Muthukumar; Zhou, Jing; Addai, Amma; Martinez, Phillip; Pandhare, Jui; Aiken, Christopher; Dash, Chandravanu (19 de diciembre de 2018). «PF74 Inhibits HIV-1 Integration by Altering the Composition of the Preintegration Complex». En Sundquist, Wesley I., ed. Journal of Virology (en inglés) 93 (6): e01741-18, /jvi/93/6/JVI.01741-18.atom. ISSN 0022-538X. PMC 6401427. PMID 30567984. doi:10.1128/JVI.01741-18. Consultado el 25 de octubre de 2019.
- ↑ Perrier, Marine; Bertine, Mélanie; Le Hingrat, Quentin; Joly, Véronique; Visseaux, Benoit; Collin, Gilles; Landman, Roland; Yazdanpanah, Yazdan et al. (1 de octubre de 2017). «Prevalence of gag mutations associated with in vitro resistance to capsid inhibitor GS-CA1 in HIV-1 antiretroviral-naive patients». Journal of Antimicrobial Chemotherapy (en inglés) 72 (10): 2954-2955. ISSN 0305-7453. doi:10.1093/jac/dkx208. Consultado el 24 de octubre de 2019.
- ↑ «Safety, Pharmacokinetics, and Antiviral Activity of GS-6207 Administered Subcutaneously in HIV-1 Infected Adults - Full Text View - ClinicalTrials.gov». clinicaltrials.gov (en inglés). Consultado el 26 de octubre de 2019.
|

