|
Fecundación in vitro La fecundación in vitro, FIV o (IVF en inglés) es una técnica reproductiva por la cual la fecundación de los ovocitos por los espermatozoides se realiza fuera del cuerpo de la madre. La FIV es el principal tratamiento para la esterilidad cuando otros métodos de reproducción asistida no han tenido éxito. El proceso implica el control hormonal del proceso ovulatorio, extrayendo uno o varios ovocitos de los ovarios maternos, para permitir que sean fecundados por espermatozoides en un medio líquido. El óvulo fecundado (cigoto) puede entonces ser transferido al útero de la mujer, en vistas a que implante en el útero y continúe su desarrollo hasta el parto. In vitroEl término in vitro es un término en latín que significa ‘en cristal’. Se utiliza porque en los primeros experimentos biológicos en los que se realizaban cultivos de tejidos fuera de los organismos vivos de los cuales procedían, se realizaban en contenedores de cristal, tales como tubos de ensayo, probetas o placas de Petri. En la actualidad, el término in vitro se refiere a cualquier procedimiento biológico que se realiza fuera del organismo en el que tendría lugar normalmente, para distinguirlo de un experimento in vivo donde el tejido permanece dentro del organismo vivo en el que normalmente se encuentra. Coloquialmente, a los bebés concebidos a través de FIV se les denominaba bebés probeta, refiriéndose a contenedores de cristal o plástico denominados probetas, que se utilizan frecuentemente en los laboratorios de química y biología. Sin embargo, normalmente la fecundación in vitro se realiza en placas planas denominadas placas de Petri; las placas de Petri utilizadas más a menudo están producidas en plástico, sin embargo, el nombre FIV sigue conservándose. IndicacionesInicialmente la FIV se desarrolló para superar situaciones de infertilidad debidos a problemas en las trompas de Falopio, pero posteriormente se observó que la técnica tenía éxito también en otros casos de infertilidad. La introducción de la inyección intracitoplasmática de espermatozoides (ICSI) soluciona en gran medida los problemas de infertilidad masculina. Para que un tratamiento de FIV tenga éxito, es necesario disponer de ovocitos sanos, espermatozoides que puedan fecundarlos y un útero que pueda mantener un embarazo. Aunque en algunos países los tratamientos de FIV están cubiertos por los servicios sanitarios sociales, normalmente se recurre a esta técnica cuando otras opciones han fallado, debido a que la FIV conlleva costos elevados. La FIV puede utilizarse también en mujeres menopáusicas, utilizando ovocitos procedentes de una donante. Asimismo es una técnica que puede considerarse en pacientes que han sufrido una pérdida total o parcial de fecundidad debido a un tratamiento agresivo frente a una patología grave (como el cáncer). MétodoEstimulación ováricaPreviamente a la fecundación in vitro, generalmente en el tercer día de la menstruación se estimula el desarrollo de folículos múltiples en los ovarios mediante tratamientos hormonales. En la mayoría de las pacientes se emplean inyecciones de gonadotropinas (generalmente análogos de la FSH), pudiendo realizar algún análisis complementario de niveles hormonales como estradiol o progesterona, y del crecimiento folicular mediante ultrasonografía ginecológica. El tiempo de estimulación necesario es variable, normalmente se necesitan 8-12 días de inyecciones. La ovulación espontánea durante el ciclo se previene por el uso de agonistas GnRH (aGnRH) o antagonistas GnRH (agGnRH), que bloquean el pico espontáneo de la hormona luteinizante (LH). Ambas generan, en otras palabras, lo que se conoce como un hipogonadismo hipogonadotrofo reversible. Sin embargo, los agonistas de la GnRH se diferencian de los antagonistas principalmente porque su efecto no es inmediato, sino que desencadenan en primera instancia un pico de FSH y LH (efecto flare-up), produciéndose un bloqueo posterior en la liberación de gonadotropinas por la saturación de los receptores de GnRH de la cascada de activación. Sin embargo, existen diferentes protocolos de estimulación que varían en el día de inicio, medicamentos empleados y métodos para prevenir e inducir el pico de la hormona luteinizante (LH). En la actualidad, se está empleando también como estimulante de la ovulación un análogo de la FSH generado por recombinación: la corifolitropina alfa. Esta molécula contiene un fragmento de la gonadotropina coriónica humana, lo que le da un perfil farmacocinético muy favorable, disminuyendo las dosis de fármaco en comparación con la FSH convencional.[1] Básicamente, si en el laboratorio el equipo se decanta por un tratamiento con aGnRH, se pueden escoger entre un protocolo corto y uno largo: - Protocolo largo: los agonistas de la GnRH se suministran a la paciente varios días antes del nuevo ciclo y durante la administración de las gonadotropinas exógenas. Entre sus múltiples ventajas destaca que, con él, se asegura la no liberación prematura de LH, lo que garantiza la invalidación de toda ovulación precoz. A su vez, este hecho permite al embriólogo planificar sin margen de error la fecha de la captación folicular. Por otra parte, se asegura que el desarrollo de los folículos se sincronice. Desgraciadamente, con la aplicación de este protocolo, la probabilidad de que se produzca un síndrome de hiperestimulación ovárica (SHO) se multiplica, y se requiere un soporte de fase lútea (administración de progesterona), así como una mayor cantidad de gonadotropinas. - Protocolo corto: los agonistas de la GnRH comienzan a suministrarse en los primeros días del ciclo, casi al mismo tiempo que las gonadotropinas exógenas. La principal virtud de este procedimiento es que consigue mejores resultados en mujeres con baja respuesta, aunque este hecho aún no ha sido completamente demostrado. En cambio, la aplicación de este protocolo multiplica el riesgo de que se produzcan picos de LH (induciendo entonces una ovulación precoz) y no posibilita un desarrollo sincrónico de los folículos. En definitiva, se establece control sobre el desarrollo folicular mucho menor. Por otra parte, cuando se emplean antagonistas de la GnRH, solo se establece un protocolo, en el cual se administra la sustancia bloqueante varios días después del inicio del ciclo, al mismo tiempo que se suministran gonadotropinas recombinantes o purificadas de la orina. Los protocolos de estimulación ovárica se han convertido en complejos y costosos. Por esto, parece haber una tendencia a nivel mundial dirigida a reducir la cantidad y la dosis de los medicamentos empleados durante la estimulación con el fin de reducir los riesgos y costos asociados a estos tratamientos [6]. Ejemplo de estos esfuerzos son los tratamientos FIV con Ciclos Naturales, además de los protocolos FIV con mínima estimulación desarrollados por los grupos de New Hope Fertility y la Kato Ladies Clinic, dirigidos por los doctores John Zhang en NY [7], el Dr. O. Kato en Tokio [8], y el Dr. Chávez-Badiola en México [9]. Extracción de ovocitosCuando se considera que la maduración de los folículos es adecuada, se administra a la paciente gonadotropina coriónica humana (β-hCG) o algún agonista de la GnRH. La primera actúa como un análogo de la hormona luteinizante (LH); mientras que la segunda induce un disparo de la propia hormona luteinizante (LH). En cualquiera de los casos, el medicamento provocará la ovulación alrededor de 36 horas después de la inyección, pero el procedimiento de extracción tiene lugar justo antes de que esto ocurra. La extracción de los ovocitos se programa unas 36 horas después de la inducción de la ovulación y se realiza por vía transvaginal, utilizando una aguja guiada por ultrasonido, que pincha la pared vaginal para alcanzar los ovarios. Un médico aspira los folículos ayudado por un ecógrafo y recoge el líquido folicular en unos tubos que serán introducidos a un termobloque hasta que pasen al laboratorio. El líquido folicular es un fluido amarillento y seroso que contiene linfocitos y células de la granulosa aisladas o formando cúmulos con o sin ovocitos. A medida que se punciona el ovario el líquido folicular se vuelve de color rojo (hemático) debido a la hemorragia provocada por la punción. La sangre es tóxica para el ovocito pues contiene muchos anticuerpos, por lo que una vez que se termine la punción habrá que eliminarla. Este paso se realiza en el laboratorio, donde se procesa el líquido de la punción con el objetivo de recuperar los ovocitos contenidos en el líquido; de esta manera se obtendrán los ovocitos, se hará un lavado de los mismos y se clasificarán según su morfología. Estos tres pasos se tienen que realizar en el menor tiempo posible para evitar el efecto de la temperatura, a la que los ovocitos son muy sensibles, y el daño producido por el líquido hemático.
Se deben aislar los complejos cúmulo-corona-ovocitos que se llegan a observar a simple vista (varios mm de diámetro). Así, una vez realizada la extracción de ovocitos, la muestra se mira al microscopio óptico para seleccionar los cúmulos ooforos. Luego, estos se limpian de las células de la granulosa para quedarnos solo con el ovocito. Este proceso se conoce como denudación.
Las punciones se programan normalmente cada 30 minutos aunque la búsqueda de los ovocitos no suele durar más de 15 minutos. En estos procesos se utiliza anestesia local, general o parcial para evitar el dolor producido por la punción. Existen 3 estadios de maduración en los cúmulos que se extraen por punción folicular, a saber: - Grado I (Maduración nuclear MII): El cúmulo y la corona del ovocito presentan un aspecto expandido. Es el estado en el cual el ovocito presenta una mayor maduración y solo los de este tipo son los que se utilizan en técnicas de reproducción asistida. - Grado III (Maduración nuclear VG): El ovocito destaca por la gran compactación del cúmulo, el cual cuenta con pocas células, muy fijadas a la zona pelúcida (ZP). - Grado II (Maduración nuclear MI): El ovocito presenta un aspecto intermedio entre los dos estadios anteriores. Esta clasificación trata de describir el ovocito y su estado de maduración nuclear estando rodeado de células del cúmulo y la corona.
Es por ello que actualmente esta clasificación no tiene gran relevancia y no debe dársele mayor importancia, salvo para indicar características que se salgan especialmente de lo considerado como normalidad: cúmulos o coronas de aspecto apoptótico o postmaduro, presencia de sangre, etc. FecundaciónVéase también: Donación de esperma
Una vez en el laboratorio, los complejos cúmulo corona ovocito extraídos se lavan en medio HEPES para mantener el pH, recortando las células de la granulosa que los rodean y preparándolos para la fecundación. Los ovocitos deben permanecer al menos 4 horas en el incubador (medio simple rico en glucosa) hasta su inseminación, es decir, aproximadamente 40 horas tras la inducción de la ovulación que sería el momento de la ovulación espontánea. Este tiempo es necesario para tener una apropiada maduración del ovocito y para que se simulen las condiciones naturales que ocurren en el útero. Si la inseminación se realiza antes o después de este periodo de tiempo, la eficiencia de la inseminación disminuirá. Al mismo tiempo, el semen se prepara para la fecundación, eliminando las células inactivas, el fluido seminal y se realiza su capacitación. Los parámetros adecuados de semen capacitado para realizar FIV son: 8-10 millones de espermatozoides por mililitro, más de 75 % de espermatozoides móviles progresivos y más de 1 % de formas normales. Si el semen proviene de un donante, probablemente habrá sido preparado antes de ser congelado y puesto en cuarentena, y cuando sea descongelado estará listo para usar. Concentraciones superiores de espermatozoides pueden producir fecundaciones anómalas (poliespermia) y una menor concentración de espermatozoides puede producir fallos de fecundación. Existen distintos protocolos de FIV pero todos se basan en el mismo principio: el esperma y el ovocito se incuban juntos (en un ratio de aproximadamente 75.000:1) en un medio de cultivo simple con glucosa durante unas 18 horas. El ovocito se fertilizará durante los primeros 20 minutos de exposición. Para fecundar un ovocito no basta con un solo espermatozoide, siendo necesario como mínimo varias decenas para deshacer la zona pelúcida (capa celular protectora). En este sentido, el primer espermatozoide en llegar no suele ser el responsable de la fecundación.[2] Si la muestra seminal posee valores inferiores a los anteriores, se recurre a ICSI en lugar de FIV. ICSI también se conoce como microinyección. Consiste en inyectar directamente el espermatozoide en el ovocito. Es la técnica más eficiente cuando los espermatozoides están gravemente dañados, es decir, cuando hay un grave problema de infertilidad en el hombre. Sin embargo, debido a la alta tasa de éxito - hay una mayor tasa de fertilización con esta técnica en comparación con FIV convencional - ICSI es la más usada mundialmente. Mientras que con ICSI 8/1000 ovocitos son fertilizados, con la FIV convencional sólo se fertilizan 4-6/1000. Por tanto, teóricamente FIV es la primera opción que se intenta debido a su similitud fisiológica pero generalmente se prefiere ICSI por su eficiencia. Trascurrido 16-18 horas se comprueba la fecundación, que ya debería haber ocurrido. Hay autores que a la media hora lavan los ovocitos para evitar la exposición a ROS, que puede formarse por la presencia de espermatozoides muertos. El cigoto humano de 15 a 20 horas tras la concepción permanece en el estadio de pronúcleos (PN). Se considera que la fecundación es correcta cuando el cigoto presenta dos PN y dos corpúsculos (CP). A veces es difícil interpretar los CP y se valoran como correctamente fecundado cualquier embrión con dos PN. Cualquier otra combinación se considera anormal y se descarta. La mayoría de las veces aparece primero el PN paterno en la posición central y el materno se acerca más tarde. Para poder realizar correctamente la fecundación, es necesario decumular o denudar previamente el cigoto. Este proceso consiste en retirar las células del Cumulus Oophorus, o cúmulo del óvulo. Esta técnica permite conocer con exactitud el estadio de maduración de los ovocitos, lo cual resulta imprescindible para realizar la inyección intracitoplasmática de espermatozoides (ICSI) en la Fecundación In Vitro (FIV). La denudación consiste en dos fases: una primera fase enzimática, donde se utiliza hialuronidasa para romper las uniones de las células del cúmulo; y otra mecánica, consistente en el desprendimiento del cúmulo mediante el paso por pipetas Pasteur (u otras herramientas destinadas al mismo fin) de diferentes calibres. El óvulo fecundado se pasa a un medio de cultivo simple (como HTF/HSA) o secuencial (G1 de Vitrolife) y se mantiene durante alrededor de 48h hasta que alcanza el estadio de 6-8 células.  Hay estudios realizados que demuestran que la liofilización del esperma de ratón permite el desarrollo de embriones normales tras la inyección de ovocitos. Cultivo de embrionesVéase también: Calidad del embrión
Una vez el óvulo ha sido fecundado y se ha obtenido un cigoto, este es cultivado para promover su división celular y crecimiento para dar lugar a un embrión. Este cultivo dura entre 5 y 7 días cuando llegan a la etapa de blastocisto, y es muy importante que se lleve a cabo en las condiciones óptimas para el embrión, ya que de ello dependerá su calidad y la tasa de implantación del mismo cuando sea transferido a un útero. Estas condiciones son:
En la primera época de la FIV la transferencia embrionaria se hacía a los 2 o 3 días después de la fecundación, porque en el laboratorio no había un ambiente adecuado para mantener el cultivo durante más tiempo. Sin embargo, la transferencia del embrión antes del día 5 tiene el inconveniente de que sus células no están sincronizadas y el ambiente del endometrio no es el ideal. Además no es posible ver la propia autoselección de los embriones durante los primeros días de su desarrollo, ya que el número de embriones potencialmente viables disminuye significativamente hasta el día 5.[3] Medios de cultivoPara que el crecimiento del embrión se lleve a cabo en las mejores condiciones posibles se utilizan distintos tipos de medio de cultivo: Medios simples: de composición sencilla y fáciles de preparar. La composición de estos medios se determina a partir de la composición teórica del líquido de la trompa (medios HTF o P1) o de la composición de medios de cultivo para el desarrollo de cigotos de ratón (medios KSOM, Earle, M16 y T6), y suelen suplementarse con suero materno o albúmina sérica humana (HSA). Son óptimos para el crecimiento inicial del embrión (hasta los 3 días de cultivo). A partir del día cuatro no garantizan el desarrollo óptimo debido al comienzo de la transcripción activa del embrión, para lo que se requieren sustancias que estos medios no contienen. Los embriones suelen ser cultivados durante 3 días antes de su implantación, periodo tras el cual alcanzarían un estadio de 6-8 células. Ello permite que el embriólogo pueda monitorizar su tasa de división celular y la activación de genes, para asegurarse de que el embrión sea viable y de que se implantará adecuadamente. Tan solo se adelantará el momento de la implantación, normalmente a los dos días de cultivo, cuando la pareja sometida a FIV cuente con pocos embriones disponibles para ser transferidos o cuando los embriones se desarrollen con lentitud. Medios complejos: su composición es más compleja, incluye vitaminas, aminoácidos, metales, suero,... Son medios comerciales que han sido diseñados para el cultivo de células somáticas en cultivo, como el medio Ham F10, de modo que aunque mejoran el desarrollo embrionario hasta blastocisto (día 5) en comparación con los medios simples, no están optimizados para el cultivo de embriones. Tras cinco días de cultivo el embrión alcanza el estadio de blastocisto, en el que está compuesto por 12-16 células y posee una alta tasa de implantación. Suelen cultivarse hasta este estadio cuando previamente se han dado abortos o fallos de implantación en la paciente. Medios secuenciales: tienen en cuenta el hecho de que el embrión atraviesa distintos ambientes desde que es fecundado en la trompa de Falopio hasta que alcanza el útero. Los medios secuenciales se componen de tres tipos de medios: un medio para la preparación de los gametos (medio simple), otro para el desarrollo hasta el día 3 (medio G1) y un tercero para alcanzar la fase de blastocisto (medio G2). Estos medios sí están optimizados para el desarrollo de los embriones hasta blastocisto pero son más sensibles a la temperatura, y por lo tanto más inestables. Las placas con las que se trabajan se bañan primero en un aceite de parafina prelavado que se utilizan como barrera protectora para evitar la evaporación rápida del medio, para mantener las muestras a salvo de contaminantes externos durante el cultivo in vitro y para ayudar a mantener la temperatura uniforme en el medio. En este, se añaden gotas con el medio hidrófilo que será en el que se mantengan los ovocitos, nunca en contacto con el aceite.[4][5] IncubadoresLos incubadores proporcionan el medio de cultivo y el ambiente adecuado, controlando las condiciones de temperatura, luz y pH. Esto será fundamental para que se produzca el correcto desarrollo embrionario y, por ende, para la obtención de embriones de buena calidad. El tipo de incubador que se utilice será determinante en la selección embrionaria. Durante el desarrollo será fundamental analizar las características morfológicas del embrión en diferentes estadios, concretamente en los 6 primeros días. Algunos parámetros que evalúan los/as embriólogos/as son el número de células, el ritmo de división, el tamaño y simetría de las células, el porcentaje de fragmentación… Fundamentalmente existen dos tipos de incubadores, los convencionales y los time-lapse.
Cambios morfológicos en el embriónEn algunos casos en reproducción asistida se opta por mantener el embrión en cultivo hasta día 5 o 6 en lugar de transferirlo en día 3. El cultivo largo presenta algunas ventajas como seleccionar mejor al embrión o aumentar la tasa de implantación. Aunque también existen algunos inconvenientes como el alto riesgo de bloqueo embrionario. Así, se observan una serie de cambios continuos en el embrión que se clasifican en estadios:
El diámetro del embrión sigue siendo en torno a 140 micras. No siempre de distingue la masa celular interna.
La morfología de la masa celular interna y del trofoectodermo se usa como criterio de calidad del embrión. Laboratorio de FIVNo existe un consenso sobre cómo debe ser un laboratorio destinado a la fecundación in vitro. Sería apropiado que fuese una sala blanca con control absoluto de todos los parámetros y con el menor número posible de superficies horizontales, pero actualmente no es así debido a su alto coste. Aun así, es necesario controlar ciertos parámetros, pues aunque los embriones son fuertes y robustos, su tasa de implantación se ve influida por las condiciones ambientales. Los parámetros más habituales controlados en un laboratorio de FIV son:
Se puede hacer con un Analizador de gases sanguíneos o un PHmetro calibrado justo antes de medir una alícuota mantenida dentro de la incubadora. La alícuota de medio utilizada para medir el pH debe ser descartada.
La localización del centro es muy importante. Los alrededores deben estar lo menos contaminados posible. Por ejemplo, una gasolinera cerca del centro es peligroso. Deben reducirse al mínimo los compuestos orgánicos volátiles (VOCs), ya que podrían tener efectos embriotóxicos (dañinos para los embriones). Algunos VOCs no son filtrables por métodos normales, y por tanto hay que emplear filtros de carbón activo con distintas concentraciones de permanganato potásico en la entrada de cualquier gas en el laboratorio. Es necesario recalcar que estos filtros tiene una vida limitada por su capacidad de absorción, por lo que hay que cambiarlos periódicamente. Existen también otros parámetros que pueden ser controlados, aunque no son tan importantes como los anteriores:
En este tipo de laboratorios siempre se va con mascarilla. También es fundamental el uso de gorros quirúrgicos. Estos gorros deben cumolir todo el pelo, desde la frente hasta abajo, para que no se contaminen las muestras ni el ambiente. En cuanto al diseño y la distribución, estos dos parámetros influyen bastante en las tasas de éxito del laboratorio. Los materiales empleados para el suelo, las paredes y el techo deben ser siempre nobles (acero inoxidable, linóleo, cerámica, etc.), y se debe evitar la presencia de superficies horizontales (para que no se acumule suciedad). Asimismo, debe procurarse tener una esclusa de entrada separada del resto de habitáculos: la sala principal (con la zona quirúrgica, incubadora y de micromanipulación distribuidas), el laboratorio de criopreservación, el laboratorio de preparación, el laboratorio de andrología y el laboratorio de DPI. El equipamiento de un laboratorio destinado a la reproducción, debe constar de una cabina de flujo laminar, un microscopio invertido con 400 aumentos y contraste de fase modular sobre una mesa antivibratoria y un incubador temporal. La unidad de trabajo consiste en: - Una cabina de flujo laminar con una superficie caliente y CO2 al 5%. - Microscopio invertido 400x con micromanipulación en una mesa anti-vibración. - Una incubadora temporal en la que se almacenan las muestras con las que estamos trabajando. Después de ser tratados, vuelven a la incubadora principal. Del mismo modo, los recursos humanos son importantes para evitar tantos errores como sea posible. Tiene que haber personal especializado visualizando el trabajo de otros. Los que trabajan en un laboratorio de FIV incluyen embriólogos, técnicos de laboratorio y personal administrativo. Selección Los laboratorios especializados en FIV han desarrollado métodos de puntuación para juzgar la calidad de los ovocitos y los embriones. Típicamente, los expertos examinan la simetría del embrión, la integridad estructural de sus células y el crecimiento general entre dos y cinco días tras la fecundación. Ahora los científicos están empezando a analizar no solo el embrión, sino también el medio en el que crece. Algunos centros están utilizando análisis químicos y fórmulas matemáticas para crear una "huella metabólica" de un embrión sano, que podría utilizarse como barómetro para estimar el potencial de supervivencia de un embrión. Otros están intentando analizar las proteínas secretadas por los embriones y a medir la cantidad de oxígeno consumido, que es una señal habitual de crecimiento.[7] Normalmente, los embriones que han alcanzado el estadio de 6-8 células se transfieren 3 días después de la extracción. En ocasiones, sin embargo, los embriones se mantienen en cultivo por un periodo más largo (unos 6 días), y la transferencia se realiza en el estadio de blastocisto, sobre todo si se observan muchos embriones de 3 días de buena calidad. Pero nunca superando los 14 días tras la fecundación. Las transferencias en estadio de blastocisto muestran mejores tasas de embarazo.[8] Se utilizan diversas clasificaciones con las que se evalúan los embriones antes de su transferencia, basándose en los estudios realizados en centros de reproducción y en la literatura científica publicada. Sobre la base de ellas, se pueden establecer cuatro categorías:
Evaluación de la calidad embrionariaEl objetivo de la fecundación in vitro es transferir el embrión con el mejor potencial de lograr un embarazo, y que deberá ser seleccionado de entre todos los disponibles en un ciclo FIV. Existen diferentes sistemas para la clasificación de embriones de acuerdo con la etapa de desarrollo en que se evalúan, así como de las diferentes asociaciones o individuos que las proponen. Sin embargo, la evaluación convencional ha mostrado ser subjetiva, no replicable y poco relacionada con pronóstico. Como consecuencia de lo anterior, algunos grupos trabajan activamente en desarrollar sistemas de selección y ranking de embriones, apoyados de sofisticados sistemas de cómputo, y con capacidad de aplicar inteligencia artificial, visión artificial, y aprendizaje profundo (Deep Machine Learning) durante el proceso.[9] Un ejemplo de tecnologías computacionales utilizadas hoy en día en algunos laboratorios, es el sistema llamado ERICA (Embryo Ranking Intelligent Classification Assistant)[10] [10]. Este sistema emplea filtros de visión artificial y Deep Learning para clasificar embriones en etapa de blastocisto con el propósito de asistir a los embriólogos en la selección de embriones.[11][12] Los estudios hasta ahora publicados con estas tecnologías sugieren resultados prometedores.[13][14] Por otro lado, la selección y clasificación convencional de embriones se fundamenta Criterios de Valoración Morfológicos de Oocitos, Embriones tempranos y Blastocitos Humanos recogidos en el consenso ASEBIR. Este consenso se ha establecido estudiando características morfológicas de los embriones y determinando su capacidad de implantación. De esta manera, los parámetros morfológicos que ayudan a determinar la calidad embrionaria son los siguientes: número de células, velocidad de división, fragmentación, tamaño y simetría de las blastómeras, multinucleación, aspecto del citoplasma y zona pelúcida. Estudiando todos estos parámetros podemos determinar la calidad del embrión.
Los embriones con fragmentación de los tipos I, II o III con un porcentaje de fragmentación inferior a 10% son considerados de tipo A (óptimos); entre 11-25% se consideran embriones tipo B y entre 26-35% son embriones tipo C (subóptimos); cuando el porcentaje de fragmentación es mayor al 35% nos encontramos ante embriones tipo D (anormales). Si la fragmentación es de tipo IV o V, los embriones se consideran directamente como anormales, independientemente del porcentaje de fragmentación. El número de fragmentos también es un factor importante, generalmente la presencia de fragmentos aislados no daña la capacidad de implantación del embrión, mientras que la presencia de numerosos fragmentos puede tener un efecto perjudicial sobre la calidad del embrión. En embriones con mucha fragmentación, se puede hacer lo que se conoce como "assisted hatching and fragments retrieval". Esta técnica de eclosión asistida consiste en perforar un poco la zona pelúcida y aspirar los fragmentos por medio de una pipeta, mejorando así la comunicación entre las células. Solo se hace en aquellos embriones con alta fragmentación, ya que es difícil de realizar y puede resultar dañina para el embrión si no se hace correctamente.
Transferencia de embrionesLos embriones se puntúan por el embriólogo según el número de células, la paridad del crecimiento, el grado de fragmentación, el estado del citoplasma... Normalmente, para mejorar las posibilidades de implantación y embarazo, se transfieren varios embriones simultáneamente. El número de embriones que se transfieren depende del número disponible, la edad de la mujer, consideraciones diagnósticas y limitaciones legales (en algunos países, el número máximo se limita a dos o a tres, en España se pueden transferir un máximo de 3 embriones). Los embriones que se consideran "mejores" se transfieren al útero de la mujer a través de una cánula de plástico muy fino, que se introduce a través de la vagina y el cérvix y se controla mediante su visualización por ultrasonidos o ecoguiada. La cánula puede ser flexible, lo cual resulta más cara pero es el más recomendable ya que reduce el daño al introducirse por la vagina hasta llegar al útero. O cánula rígida, más barata pero menos eficaz. Hay que tener cuidado con estimular el útero al realizar la transferencia. Si se punza el útero con la cánula puede dar lugar a contracciones del útero, perjudiciales para la implantación del embrión tras la transferencia. Por lo tanto no son recomendadas la utilización de la pinzas Pozzi o cualquier instrumento que punce o agreda el cuello del útero ya que provoca contracciones perjudiciales para el embarazo. Para disminuir el riesgo de contracciones se le administra a la mujer receptora de los embriones progesterona, que es una hormona que relaja el músculo liso y evita las contracciones. 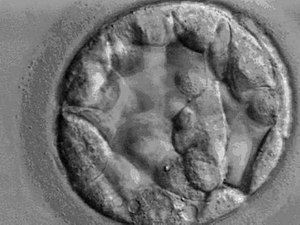 Tasas de éxitoEn EE. UU. la tasa de nacidos vivos vía FIV es alrededor del 27% por ciclo (con una tasa de embarazo del 33%), pero las posibilidades de éxito varían mucho dependiendo de la edad de la mujer (o más concretamente, de la edad de los ovocitos que se utilizan).[11] Cuando se utilizan los propios ovocitos de la mujer (y no de donante), para mujeres por debajo de los 35 años la tasa de embarazo es alrededor de 43% por ciclo (36,5% de nacidos vivos), mientras que para mujeres por encima de 40 la tasa cae drásticamente, hasta solo un 4% para mujeres por encima de 42 años.[12] Otros factores que determinan la tasa de éxito incluyen la calidad de los ovocitos y los espermatozoides, la salud del útero y la experiencia de la clínica. Normalmente se transfieren varios embriones simultáneamente, para mejorar la tasa de éxito, lo que tiene como contrapartida el riesgo de embarazo múltiple. Una técnica reciente consiste en sumergir un embrión en un cultivo de nutrientes durante 5 días hasta que alcanza el estadio de blastocisto. Los médicos determinan entonces qué embriones son los que tienen más posibilidades de desarrollarse. Los de mejor calidad se transfieren al útero de la mujer. De esta manera es posible mejorar la tasa de embarazo sin aumentar el riesgo de embarazo múltiple. Esta es una técnica relativamente nueva y está en fase de experimentación. La Asociación Americana de Medicina Reproductiva (ASRM) opina que ya existe evidencia científica suficiente que demuestra que la transferencia de blastocistos es la mejor opción en pacientes de buen pronóstico. ASRM recomienda la transferencia de un solo embrión para minimizar la probabilidad de tener un embarazo múltiple.[15] Las clínicas con programas de FIV generalmente publican sus tasas de embarazo. Sin embargo, es difícil hacer comparaciones entre clínicas, debido a que los resultados son la consecuencia de muchas variables. Además, los resultados también dependen mucho del tipo de pacientes seleccionados. Hay muchas razones por las cuales puede no conseguirse un embarazo después de un tratamiento de FIV y transferencia de embriones, entre las cuales se incluyen:
De acuerdo con un estudio sueco del año 2005 publicado en la revista de Oxford "Human Reproduction",[17] 166 mujeres fueron controladas comenzando un mes antes de sus ciclos de FIV, y los resultados no mostraron correlación significativa entre los resultados de la FIV y el estrés psicológico. El estudio concluía con la recomendación a las clínicas de que si se informaba a los pacientes de FIV de los resultados de dicho estudio, podría ser posible reducir el estrés experimentado durante el protocolo de tratamiento. Aunque tal vez el estrés psicológico experimentado durante un ciclo puede no afectar al resultado de la FIV, es posible que la experiencia de la FIV pueda resultar en estrés que aumente las probabilidades de depresión. Solo las consecuencias económicas de la FIV (si se recurre a una clínica privada) pueden generar ansiedad y resultar abrumadoras. Sin embargo, para muchas parejas la alternativa es la infertilidad, y la experiencia de la infertilidad en sí misma también puede causar estrés y depresión. ComplicacionesLa mayor complicación de la FIV es el riesgo de embarazo múltiple.[13] Este está relacionado directamente con la práctica de transferir embriones múltiples para aumentar la tasa de embarazo. Los embarazos múltiples están relacionados con un incremento en el riesgo de aborto, complicaciones obstétricas, nacimiento prematuro y morbilidad neonatal con la posibilidad de daño a largo plazo. En muchos países existen límites estrictos al número máximo de embriones que pueden transferirse, para reducir el riesgo de embarazo múltiple (trillizos o más). También puede ocurrir una división espontánea del embrión en el útero (como en un embarazo natural), pero este es un caso raro, que genera gemelos idénticos. Un estudio clínico randomizado doble ciego siguió los embarazos tras FIV que generaron 73 bebés (33 niños y 40 niñas) y concluyó que el 8.7% de los bebés únicos y el 54.2% de los gemelos tenían un peso al nacer < 2500 gr.[18] En ciclos donde se transfieren dos embriones la probabilidad de tener un embarazo gemelar es del 6%. En ciclos donde se transfieren tres embriones la probabilidad de tener un embarazo gemelar es del 12% y de tener un embarazo triple es del 3%. Otro riesgo de la estimulación ovárica es el desarrollo del síndrome de hiperestimulación ovárica, con un riesgo para la paciente inferior al 1%. Si el problema de infertilidad subyacente está relacionado con anormalidades en la espermatogénesis, es posible que la descendencia masculina tenga mayor riesgo de presentar el mismo problema. Defectos relacionados con la EpigenéticaLa epigenética se define como el estudio de los mecanismos que regulan la expresión de los genes sin una modificación en la secuencia del ADN. Las marcas epigenéticas definen la capacidad de desarrollo del cigoto y promueven la diferenciación hacia distintos tipos celulares. Todas las técnicas de la fecundación in vitro tienen consecuencias en las marcas epigenéticas que pueden suponer problemas de infertilidad, riesgos en la supervivencia del feto o efectos fenotípicos en el embrión.</23> Utilizando un modelo de ratón, compararon simultáneamente la concepción natural y gestación; blastocistos concebidos naturalmente que fueron transferidos a receptores pseudopreñados (ET); blastocistos concebidos in vivo después de la superovulación que se transfirieron a receptores pseudopreñados (SET) y procedimientos de FIV, que incluyen superovulación, FIV y cultivo de embriones a la etapa de blastocisto antes de la ET. Los hallazgos demuestran que incluso una mínima manipulación in vitro como la NSET puede afectar el desarrollo placentario. Es importante destacar que, a medida que aumenta el número de manipulaciones, la morfología y el fenotipo molecular de la placenta se vuelve más severo. </24> La placenta [placenta] es conocida por su notable plasticidad en comparación con otros órganos; es capaz de responder a los cambios causados por trastornos genéticos y factores de estrés ambiental a través de mecanismos epigenéticos, incluida la metilación del ADN. Los cambios epigenéticos inducidos por la FIV persisten en los tejidos como el cerebro y el hígado son los más afectados y derivan del ectodermo y el endodermo, respectivamente, lo que indica que las alteraciones ocurrieron en una etapa temprana del desarrollo, desde la diferenciación del trofectodermo. El período prenatal es una ventana crítica del desarrollo. Los fenotipos observados en este estudio, a saber, el bajo peso al nacer y la placentación anormal están ciertamente implicados en la etiología de las enfermedades cardiovasculares y metabólicas, y se justifica una investigación adicional sobre los efectos a largo plazo para la salud de la terapia.</24> Defectos en los bebésEl tema de la presencia de defectos asociados a la técnica de FIV permanece controvertido. La mayoría de los estudios muestran que no existe un incremento significativo tras una FIV, mientras que otros no apoyan este hecho.[19] Algunos investigadores consideran que manipular gametos y embriones fuera del cuerpo podría estimular la aparición de cambios genéticos (mutaciones) que se pueden manifestar como defectos congénitos en el nacimiento.[20] Aunque no hay evidencia genética que apoye esta idea, algunos estudios epidemiológicos sugieren una posible conexión entre la reproducción asistida y síndromes genéticos poco frecuentes en recién nacidos, como el síndrome de Beckwith-Wiedemann, que se caracteriza por nacimiento prematuro, lengua más grande de lo normal y mayor susceptibilidad a tumores y defectos respiratorios y oratorios.[21] Este síndrome es raro: afecta solo a 1 de cada 12 000 recién nacidos en todo el mundo, pero algunos estudios sugieren que es más frecuente en niños nacidos con técnicas de reproducción asistida.[22][23] Sin embargo, el riesgo absoluto de tener un bebé que presente el síndrome de Beckwith-Wiedemann es bajo, por lo que los expertos encuentran difícil aconsejar a una pareja con problemas de fertilidad no seguir adelante con las técnicas de reproducción asistida. Algunos investigadores sugieren que tal vez podrían reducirse los riesgos potenciales si se evitan ciertos procedimientos invasivos cuando no sean estrictamente necesarios, como las biopsias de embriones implantados, el cultivo de embriones en el laboratorio por periodos superiores al mínimo necesario y el uso de ICSI en ausencia de problemas de fertilidad masculina. CriopreservaciónCriopreservación de embrionesCuando se generan embriones múltiples tras la FIV, los pacientes pueden elegir congelar los embriones que no se transfieren al útero de la mujer. Esos embriones se mantienen en nitrógeno líquido congelados hasta un máximo de 5 años. Según se publicó en 2006, en EE. UU. había cerca de 500 000 embriones congelados.[14] La ventaja es que los pacientes que no consiguen concebir tras el primer ciclo pueden reintentarlo utilizando los embriones congelados, sin tener que realizar de nuevo un ciclo de FIV completo: solo tendrían que realizar la transferencia de dichos embriones, sin pasar de nuevo por la estimulación, la extracción y la fecundación. O, en el caso de pacientes que consiguen un embarazo, pueden mantenerlos para un segundo embarazo posterior. Los embriones restantes procedentes de FIV pueden donarse a otras mujeres o parejas para reproducción o para investigar con ellos. Existen diferentes técnicas para criopreservar (congelar) embriones, cada una con diferentes posibilidades de lograr la supervivencia. En la actualidad el método más efectivo es la vitrificación (supervivencia de hasta 98 %) [15], lo que a su vez ser refleja en una posibilidad de hasta el 50 % de embarazo con embriones congelados, según reportes en la literatura médica [16]. Esta técnica se caracteriza por una rápida velocidad de congelación (-23.000 °C/min), lo que impide la formación de cristales con efecto cuchilla que podrían dañar al embrión. Si, a pesar de todo, siguen existiendo embriones criopreservados que, por el tiempo transcurrido o por otras razones, no vayan a utilizarse para su implantación, las dos alternativas posibles (que normalmente están reguladas por leyes estrictas) son la donación para la investigación y la destrucción. En el caso de donación de embriones para investigación, ésta se debe llevarse a cabo en centros acreditados y sobre la base de proyectos autorizados por las autoridades correspondientes. Normalmente, se establecen plazos postfecundación para la investigación en los embriones y, una vez terminada la investigación, no se permite llevar a cabo una transferencia embrionaria con ellos. La investigación con embriones procedentes de FIV ha permitido hasta el momento la realización de estudios en células madre, de gran importancia en la comprensión del desarrollo embrionario y en el avance de las terapias regenerativas de tejidos. En cuanto a la destrucción de los embriones congelados, se considera como última alternativa, a petición explícita de los progenitores, o bien cuando no los quieran para ellos y no hayan autorizado la donación a otras parejas ni la investigación en ellos. Tanto la utilización de embriones para fines de investigación como su destrucción generan extensos debates éticos entre partidarios y oponentes, que se traducen en leyes que limitan las posibilidades existentes, muy variables dependiendo de los países. En España el período que obliga la ley a mantener los embriones congelados es de cinco años. Será en este momento cuando la clínica que posee los embriones congelados deberá contactar vía carta para solicitar las acciones a llevar a cabo con los embriones. Tras pasar 5 años, y sin haber conseguido respuesta por parte de los dueños de los embriones congelados, será la clínica responsable de los embriones pudiendo utilizarlos para las 3 causas mencionadas anteriormente. Criopreservación de ovocitosLa criopreservación de ovocitos maduros sin fertilizar ha sido llevada a cabo con éxito, por ejemplo en mujeres que tienen alta probabilidad de perder sus reservas de ovocitos debido a que deben ser sometidas a un proceso de quimioterapia.[24] En un estudio con donantes, no hubo diferencias significativas entre el uso de ovocitos frescos y ovocitos vitrificados (tipo de criopreservación). La tasa de fecundación fue, respectivamente, de 80,7 y 78,2%; la aparición de embriones de buena calidad eran de 54,1 y 49,8%, las de implantación 33,3 y 34,0% y los porcentajes de bebés nacidos por ciclo fueron 38,4 y 43,4%. Es decir, los estudios mostraron equivalencias en la implantación, producción del embarazo y continuación de la gestación entre ovocitos vitrificados y ovocitos frescos. En un segundo estudio en el que se utilizaban los ovocitos propios se analizaron los resultados de cinco ensayos clínicos, comparando la fecundación, la calidad de los embriones, la producción del embarazo y la continuación de la gestación a partir de 4282 ovocitos vitrificados y 3524 ovocitos frescos. Los datos no eran diferentes en los dos grupos y la tasa de supervivencia de los ovocitos vitrificados era de un 93%. En 2014 un metaanálisis incluyó 21 estudios prospectivos y concluyó que la eficiencia de los ovocitos era de un 7%, similar a la estimada de los ovocitos frescos. Además, tampoco se vieron diferencias entre ovocitos que habían estado congelados menos de 6 meses y aquellos que llevaban congelados más de 5 años. De hecho, el mayor almacenamiento de un óvulo que resultó en un bebé ha sido de 14 años.[25][26] Criopreservación del tejido ováricoLa criopreservación del tejido ovárico va dirigida a pacientes que van a sufrir tratamientos quimioterápicos agresivos que pueden destruir sus tejidos reproductivos, provocando así su infertilidad. Así que, aunque hoy en día estos tratamientos sean un gran avance en la supervivencia no lo son en la calidad de vida, por lo que era necesario el desarrollo de una técnica así. Técnica que aún está en estudio por su complejidad.[27] Este tejido tiene un doble componente fisiológico, la parte endocrina y la reproductora. Por lo que su regulación legislativa es compleja. Todo lo referente a ello se encuentra regulado, de manera adecuada, por la Organización Nacional de Trasplantes. La obtención del material debe realizarse previo al tratamiento tóxico. El material obtenido debe tener un espesor fino para poder difundir la solución crioprotectora.[28] Lo más preocupante es el riesgo de enfermedad residual[29] que pueda ser reinsertado en la paciente. Para ello contamos con diferentes técnicas de diagnóstico in vitro que nos permitan analizar el tejido con la finalidad de encontrar restos de dicha enfermedad residual. A la hora de realizar el trasplante de vuelta, es preocupante la pérdida folicular. Por ello, se está creando un tejido de granulación que favorezca la angiogénesis. Todo esto está en fase de perfeccionamiento pero sin lugar a dudas sería un gran avance para la sociedad y para la medicina Intervenciones asociadasExisten algunas variaciones o mejoras de la FIV, tales como ICSI, IMSI, Transferencia pronuclear, MST, ZIFT, GIFT y PGD. 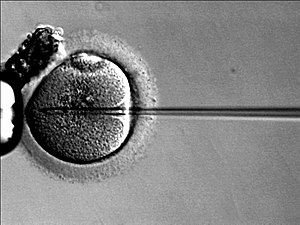 ICSILa inyección intracitoplasmática de espermatozoides (ICSI) es un desarrollo reciente asociada a la FIV que permite inyectar directamente un espermatozoide en el citoplasma del ovocito utilizando técnicas de micromanipulación. Se utiliza cuando los espermatozoides tienen dificultades para penetrar en el ovocito o en caso de que el recuento de espermatozoides sea muy bajo, ya sea por oligospermia o por azoospermia obstructiva. En esos casos se pueden obtener espermatozoides de la pareja por distintos medios, como la biopsia testicular, o de un donante de esperma. Los espermatozoides deben sufrir un proceso de selección que permita elegir el que tiene mejores características para la fecundación. Así, se evalúan parámetros como la morfología o la motilidad. Cuando finalmente se selecciona un único espermatozoide, se introduce en una microaguja de inyección. El óvulo se fija con una micropipeta de sujeción para evitar que se mueva, aplicando una succión leve. Se inyecta el espermatozoide en el interior del citoplasma del óvulo, produciéndose la fecundación. Tiene unas tasas de éxito muy elevadas, siendo superiores al 90%. La tasa de éxito es aún mayor en los casos en los que se utiliza un espermatozoide de un donante. Inyección intra citoplasmática de espermatozoides morfológicamente seleccionados (IMSI)La IMSI o Inyección intra citoplasmática de espermatozoides morfológicamente seleccionados (del inglés: Intracytoplasmic morphologically-selected sperm injection) es una técnica de fecundación in vitro (FIV). Consiste en realizar una selección morfológica de los espermatozoides antes de inyectarlos en los ovocitos. Se selecciona un espermatozoide utilizando un microscopio invertido con una magnificación de más de 6000 veces su tamaño con el fin de observar con más precisión la composición de la cabeza de los espermatozoides, detectando posibles anomalías de las vacuolas o los daños de la cadena de ADN de los espermatozoides y escogiendo solo los que no presentan anomalías para proceder a la fertilización con los ovocitos. Eclosión Asistida (Assisted Hatching)Antes de la transferencia, los embriones están envueltos por una capa de glicoproteínas y, para lograr un embarazo, los embriones deben romper y salir de esta envoltura antes de implantarse. Está envuelta se llama zona pelúcida y la eclosión asistida (assisted hatching) consiste en realizar un orificio en esta zona para facilitar el proceso de eclosión del embrión y así aumentar la tasa de implantación. La eclosión asistida(también llamada AHA) es una técnica que se lleva utilizando desde los años 80, cuando se vio que los embriones de PZD (disección parcial de la zona pelúcida) efectivamente parecían tener una tasa de implantación más alta que los embriones normales. Este método se puede realizar cualquier día de desarrollo, aunque normalmente se suele hacer en el tercero. Aunque es un proceso que ocurre también de manera fisiológica, existen ciertas causas por las cuales un embrión es incapaz de realizar el proceso de eclosión (hatching) natural, entre las que destacan:
En estas ocasiones es cuando se recurre a procesos de eclosión asistida (assisted hatching), que puede estar acompañada o no de la aspiración de fragmentos celulares, dependiendo de la causa anteriormente mencionada. No obstante, existen otros motivos por los cuales se puede llevar a cabo, como es el caso de realizar un diagnóstico preimplantacional. En este caso, se suele realizar como paso previo al mismo. Existen diferentes formas de hacer Eclosión Asistida, ya sea por el método químico, mecánico o con láser. Este último es el que ha ganado más popularidad por sus buenos resultados. Método químico: consiste en introducir ácido de Tyroide, que es una solución salina tamponada con un pH de 2,5 (con un margen de error de 0,3), en una pipeta de AHA. Al embrión, por otra parte, se le tiene sujetado con una micropioeta de sujeción y en una solución de 20 microlitros de HEPES. Se acerca la pipeta con la solución de Tyrode y se libera en las cercanías del embrión. La zona pelúcida se va degradando, ya que al ser un pH tan bajo, se desnaturalizan las proteínas que la forman, dando lugar a un orificio en esa zona.Una vez formado, se aspira con la pipeta esta solución para que no afecte al interior del embrión, y alejamos al embrión de esta zona. La ventaja de este método es que es económico y los extremos son suaves. Los inconvenientes que tiene este método son: el embrión se expone a una solución ácida incrementando el riesgo de daño de este y, además, la apertura es permanente con lo que puede ser perjudicial por afectar al medio interno del embrión. Método mecánico: este método se realiza en 20 microlitros de medio con HEPES y consiste en fijar con una pipeta de sujeción el embrión, por otra parte se toma una pipeta (PZD) con la que se atraviesa tangencialmente la zona pelúcida. Una vez atravesado el embrión, se suelta y se rasga la zona contra la pipeta de sujeción. En este caso como resultado final obtenemos un ojal que se mantiene cerrado y por el cual después el embrión le será fácil salir e implantar. El ojal puede tener unas dimensiones de 50 micras aproximadamente. Las ventajas que tiene este método son: que el embrión está más protegido por el efecto que hace el ojal, es más natural que los demás métodos y además es más barato. En cambio su inconveniente es: que es difícil de aprender, además de laborioso. Método físico(láser): este método se realiza en un medio con HEPES en donde se encuentra el embrión. El láser de diodo infrarrojo (1,48 micras) se apunta y dispara, a través del objetivo, cerca de donde se encuentra el embrión. Se puede variar el tiempo de acción del láser (0,1 a 50 ms). El láser calienta localmente el agua, y al aumentar la temperatura hace que las proteínas que constituyen la zona pelúcida cercanas al láser se desnaturalicen y así se origine un orificio. La forma del orificio del láser es un ojal abierto siempre mayor al que se ve en el plano del microscopio. La ventaja de este método es que es muy rápido además de reproducible, en cambio sus desventajas son: es muy caro, se expone al embrión a un riesgo como es el propio láser, y la abertura es permanente además de que es más grande de lo que parece y esto como hemos dicho antes puede afectar al embrión. Hay que decir que esta técnica solo ofrece ventajas en los siguientes casos: -mujeres mayores de 37 años. -Fallo de gestación tras FIV/ICSI. y otras indicaciones propuestas pero aún no demostradas: -Zona pelúcida anormal. -Mala calidad embrionaria. -Baja respuesta ovárica. Por último, es oportuno decir que también se ha intentado la eclosión total del embrión a través del método químico o con pronasa. Solo es posible realizarlo en estadio de blastocisto, ya que si se hiciera antes se disgregaría el embrión en sus blastómeras. Pero esta técnica apenas se utiliza en el laboratorio. Transferencia nuclear o pronuclearEn la transferencia nuclear o pronuclear (pronuclear transfer) se toman los pronúcleos de un ovocito recién fecundado, tanto el materno como el paterno, y se transfieren a un ovocito previamente enucleado de una donante. El ovocito de la donante, por tanto, será el que proporcione todas las herramientas de división celular, así como los orgánulos. De esta forma se consigue que todo el ADN nuclear (genética cromosómica) del embrión proceda de ambos progenitores, siendo solamente el ADN mitocondrial de la donante. La transferencia nuclear no es legal en mucho países, no obstante, ofrece una aplicación clínica esperanzadora para aquellas mujeres con enfermedades mitocondriales o con edades avanzadas que deseen engendrar hijos sanos. Transferencia del spindle (MST)En la transferencia del spindle (maternal spindle transfer o MST) se toman los ovocitos en metafase II, última fase de la maduración ovocítica previa a la fecundación. En este estadio, los cromosomas se encuentran dispuestos en un 'spindle complex' o complejo del huso alineados. En esta técnica se transfiere el 'spindle' de la paciente a un ovocito de una donante previamente enucleado. De esta forma, al igual que en la técnica anterior se consigue evitar cualquier enfermedad asociada al ADN mitocondrial, pues aunque el ovocito transferido conservaría el ADN nuclear de la paciente; el mitocondrial procedería de la donante. Lo que diferencia a esta técnica de la anterior es que se realizaría previo a la fecundación con el espermatozoide. Transferencia intrafalopiana de cigotosEn la transferencia intrafalopiana de cigotos (ZIFT en inglés), los ovocitos se extraen de la mujer, fecundados in vitro, y los embriones se sitúan en las trompas de Falopio, en lugar de en el útero. TGIFEn la TGIF (GIFT en inglés), los ovocitos se extraen de la mujer, y se sitúan en una de las trompas de Falopio, junto con los espermatozoides del varón. Por tanto, esta variación es en realidad una fecundación in vivo y no in vitro. EGP (PGT)El EGP Estudio Genético Preimplantación), puede realizarse en los embriones previamente a la transferencia. Un test similar pero más general es el haplotipado genético preimplantación o HGP (PGH en inglés). Sin embargo, la tasa de éxito de la DGP es baja. Mini FIVOriginalmente desarrollado por los grupos de New Hope Fertility[30] y la Kato Ladies Clinic, [17] [18] [19] el Mini FIV tiene la particularidad de estimular el ovario de forma muy sutil con el empleo mínimo de medicamentos hormonales.[31] El resto de etapas en las técnicas de Mini FIV son similares a las del FIV tradicional, aunque con cambios menores dirigidos a reducir el riesgo y las molestias para las pacientes.[32] Esta técnica está recomendada para mujeres con buen pronóstico,[33][34] pacientes que no pueden recibir una estimulación de óvulos completa o para mujeres que no desean recibir un tratamiento hormonal más agresivo.[35] Actualmente, y de acuerdo con la Sociedad Americana de Reproducción Asistida (ASRM), el Mini-FIV se considera como el protocolo de elección para pacientes con baja reserva ovárica, y pobres respondedoras.[36][37] Los retos que implica trabajar con un menor número de folículos demanda que el Mini-FIV sea realizado por un equipo con amplia experiencia en esta técnica,[36][38] y en laboratorios con tecnología de punta.[39][40] HistoriaEl primer embarazo conseguido mediante FIV con un ovocito humano fue descrito por el equipo de Monash en la revista The Lancet en 1973, aunque solo duró algunos días y hoy en día se denominaría un embarazo bioquímico. A continuación se publicó un embarazo ectópico en las trompas por Steptoe y Edwards en 1976 .[41] En 1978, Edwards, Steptoe y Jean Marian Purdy lograron el primer nacimiento por FIV ,[42] la niña Louise Brown nació el 25 de julio de 1978 en el Royal Oldham Hospital de Láncashire, cerca de Mánchester (Reino Unido)[43] y de otro bebé desconocido, los primeros bebés FIV.[cita requerida] Robert G. Edwards recibió el Premio Nobel de Fisiología y Medicina 2010 por el desarrollo de la fecundación in vitro'.[44] Después tuvo lugar el nacimiento de Candice Reed en Melbourne en 1980. La utilización del uso de ciclos estimulados con citrato de clomifeno y el uso de gonadotropina coriónica humana (hCG) para controlar el momento de la maduración de los ovocitos, permitiendo así controlar el momento de la extracción, convirtió a la FIV de una herramienta de investigación en un tratamiento clínico. A continuación se produjeron 14 embarazos, seguidos de 9 nacimientos en 1981 con el equipo universitario de Monash. El equipo de Jones en Norfolk, Virginia, mejoró los ciclos de estimulación incorporando el uso de una hormona estimulante de los folículos (uHMG). Esto se dio a conocer con el nombre de hiperestimulación ovárica controlada (HOC). Otro paso adelante fue el uso de agonistas de la hormona que libera la gonadotropina (GnRH-A), disminuyendo así la necesidad de control al prevenir la ovulación prematura, y más recientemente antagonistas de la hormona que libera la gonadotropina (GnRH-Ant), con una función similar. El uso adicional de contraceptivos orales ha permitido la programación de los ciclos de FIV, lo que hace el tratamiento más fácil de realizar para los médicos y los pacientes. En España en abril de 1984 se realizó la primera fecundación in vitro, por los ginecólogos Pedro Barri y Ángel Sopeña, y la doctora Marisa López Tapia.[45] El primer bebé por FIV en América Latina nació en Colombia en 1985, en el laboratorio del Dr. Elkin Lucena gracias a la colaboración científica con expertos madrileños. El mismo equipo también es responsable de los primeros embarazos por congelación de embriones en América Latina.[46] La capacidad de congelar y posteriormente descongelar y transferir embriones también ha mejorado significativamente la efectividad de la FIV. Otro momento significativo fue el desarrollo de la inyección intracitoplasmática de espermatozoides (ICSI) por Gianpiero Palermo en Bruselas, en 1992. Esto ha permitido que hombres con una producción mínima de espermatozoides consigan embarazos, a veces conjuntamente con recuperación de esperma, utilizando una aguja testicular fina o una biopsia testicular abierta, de manera que incluso hombres con el síndrome de Klinefelter pueden a veces conseguir un embarazo. Por tanto, la FIV se ha convertido en la solución de la mayoría de los problemas de infertilidad, desde problemas en las trompas hasta factores masculinos, subfertilidad idiopática, endometriosis, edad materna avanzada y anovulación. Cuestiones éticasPostura de la Iglesia católicaLa Iglesia católica se opone a la FIV porque podría dar lugar a la eliminación de embriones; en el catolicismo, un embrión se considera un individuo con alma que debe ser tratado como una persona.[47] Véase también
Referencias
BibliografíaPatricio Ventura‐Juncá, Isabel Irarrázaval , Augusto J. Rolle , Juan I. Gutiérrez , Ricardo D. Moreno, Manuel J. Santos. In vitro fertilization (IVF) in mammals: epigenetic and developmental alterations. Scientific and bioethical implications for IVF in humans. Ventura‐Juncá et al. Biol Res (2015) 48:68. DOI 10.1186/s40659-015-0059-y Ric de Waal, Lisa A. Vrooman, Erin Fischer, Teri Ord et al. The cumulative effect of assisted reproduction procedures on placental development and epigenetic perturbations in a mouse model. Human Molecular Genetics, 2015, Vol.24, No24 ; 6975-6985. doi: 10.1093/hmg/ddv400 Bibliografía adicional
Enlaces externos
|